Las vasculitis son procesos inflamatorios de la pared de los vasos sanguíneos que conducen a la necrosis por liberación de mediadores y citoquinas, y/o forman granulomas.
En cada una de ellas, están implicados diversos mecanismos con participación de complejos inmunes circulantes, inmunidad celular con formación de granulomas, la estimulación directa de receptores linfocitarios por superantígenos, los anticuerpos anticitoplasma del neutrófilo y otros mecanismos no bien conocidos.
Las vasculitis pueden ser primarias o secundarias, cutáneas o sistémicas. Las primarias son de etiología desconocida y se estima que representan el 50 % del total. Las secundarias pueden ser producidas por numerosos agentes o enfermedades: drogas (10 a 15 %), pesticidas y plaguicidas por contacto o aspiración; bacterias, hongos y virus (en especial, HVB y HVC, sepsis, reactivación de infección herpética, histoplasmosis subaguda: 15 a 20 %); enfermedades autoinmunes (SS, LES, DM, AR, urticaria-vasculitis, enfermedad de Crohn: 15 a 20 %), neoplasias sólidas, hematológicas, mieloproliferativas y linfomas (menos del 5 %). También se presentan en forma crónica en enfermedades genéticas (síndromes autoinflamatorios). Son un epifenómeno en picaduras de insectos, ectoparasitosis, micosis profundas y borde de úlceras, y constituyen un hallazgo histopatológico.
Tanto en las primarias como en las secundarias, se postulan factores genéticos y ambientales que condicionarían su aparición; se destacan la exposición ambiental al sílice y pesticidas, el tabaco e infecciones (S. aureus y Streptococcus, entre otros).
Las vasculitis cutáneas suelen ser de pequeño vaso, pero pueden coexistir con afectación de órganos sistémicos y afectar al mismo tiempo vasos de mayor calibre, hipodérmicos, como en la poliarteritis nudosa (PAN). Por lo general, las cutáneas puras son episódicas, de origen medicamentoso y duran no más de 3 o 4 semanas.
La clasificación de vasculitis más conocida y adoptada es la de Chapell Hill de 2012, basada en el diámetro predominante de los vasos afectados: pequeños, medianos y grandes (cuadro 1).
Cuadro 1: Clasificación de las vasculitis
|
Vaso pequeño (vasculitis alérgica leucocitoclástica) |
Púrpura de Schönlein Henoch
Urticaria vasculitis Vasculitis crioglobulinémica Primarias Secundarias a infecciones, drogas, neoplasias, colagenopatías. Ambientales, físicas, genéticas |
| ANCA positivas
(con granulomas) PR3+ MPO+ |
Granulomatosis con poliangitis (limitada o severa)
Poliangitis microscópica (PAM) Granulomatosis con eosinofilia (enfermedad de Churg Strauss) |
|
Vaso pequeño y/o mediano (ANCA neg) |
Poliarteritis nudosa: cutánea o sistémica
Enfermedad de Kawasaki |
| Vaso grande
(ANCA neg) |
Arteritis temporal
Enfermedad de Takayasu |
Deben distinguirse las vasculitis de la vasculopatía, como término más amplio, la cual incluye otros mecanismos patogénicos de daño del vaso y puede no evidenciar signos inflamatorios de las vasculitis (infiltrados, necrosis); por ejemplo, vasculopatía livedoide, crioglobulinemia tipo I, vasculopatía por inyección de cocaína con levamisol, lepra de Lucio).
Epidemiología
La frecuencia de las vasculitis va en aumento; las más frecuentes son las vasculitis alérgicas leucocitoclásticas, llamadas «venulitis necrotizantes» o «vasculitis por hipersensibilidad» (y dentro de ellas la púrpura de Schönlein Henoch). Clínicamente, se caracterizan por la púrpura palpable, que no desaparece a la presión.
Su incidencia global es de 28 a 54 casos/millón. La púrpura de Schönlein Henoch afecta a 20/1.000.000, en su mayoría menores de 20 años, y es más rara en adultos.
La vasculitis reumatoide (VR) ha disminuido su frecuencia en las últimas décadas, probablemente por el diagnóstico temprano de la artritis reumatoidea (AR) y los nuevos tratamientos más efectivos, y afecta a 7,9/1.000.000. La enfermedad de Kawasaki, que es la causa más común de enfermedad cardíaca adquirida en niños en Japón, Europa y Norteamérica, llegó a la Argentina en los años ochenta. La enfermedad de Behçet alcanza su mayor incidencia en Turquía: 380/100.000. La llamada «poliangitis microscópica» (PAM) prevalece en Japón y el sur de Europa, y la poliangitis granulomatosa de Wegener, en el norte de Europa. Las arteritis de células gigantes tienen una incidencia de 15-35/100.000 en Escandinavia; dentro de ellas, la enfermedad de Horton es de 20/1.000.000 entre personas de entre 65 y 74 años, y la de Takayasu, de 1-2/1.000.000.
Vasculitis de vasos pequeños
Afectan capilares, arteriolas y vénulas. Se caracterizan en la histopatología (HP) por la angeítis alérgica leucocitoclástica (necrosis fibrinoide de la pared, extravasación de eritrocitos, edema, leucocitoclasia con producción de polvo nuclear y daño endotelial).
Los complejos inmunes circulantes estimulan la lisis del complemento, la quimiotaxis de neutrófilos (N) y eosinófilos (E), y la expresión de moléculas de adhesión que guían a los N en su rolling a través de los endotelios, atraviesan la pared y liberan enzimas elastolíticas y especies de oxígeno reactivo. Los complejos inmunes circulantes se atrapan en zonas de bifurcación por la mayor lentitud del flujo a ese nivel.
Púrpura de Schönlein Henoch o vasculitis por IgA
Se trata de una vasculitis leucocitoclástica de vasos pequeños, indistinguible de la nefropatía por IgA. Es más común en edad escolar, más severa en adultos que en niños y responsable del 1,6 a 3 % de los casos de insuficiencia renal.
La infección por estreptococo ß hemolítico, diversos virus y drogas (penicilina, eritromicina, sulfonamidas y anticonvulsivantes) pueden ser desencadenantes.
Los criterios diagnósticos son púrpura palpable más al menos uno de estos cuatro criterios: dolor abdominal (GI) difuso, biopsia con depósito de IgA, artritis o artralgia, hematuria y/o proteinuria.
Las lesiones cutáneas de púrpura palpable se ubican en miembros inferiores, pero pueden ascender al abdomen, el tronco y los miembros superiores (foto 1). Es posible que persistan brotes por años. Se acompañan de dolores abdominales y articulares. El compromiso GI es más común que el renal (43 a 55,8 % vs. 20,9 %) y puede ser su forma de inicio. Dentro de las complicaciones, se encuentra la intususcepción ileocecal o ileocólica (es importante pedir ecografía abdominal y sangre oculta en materia fecal).
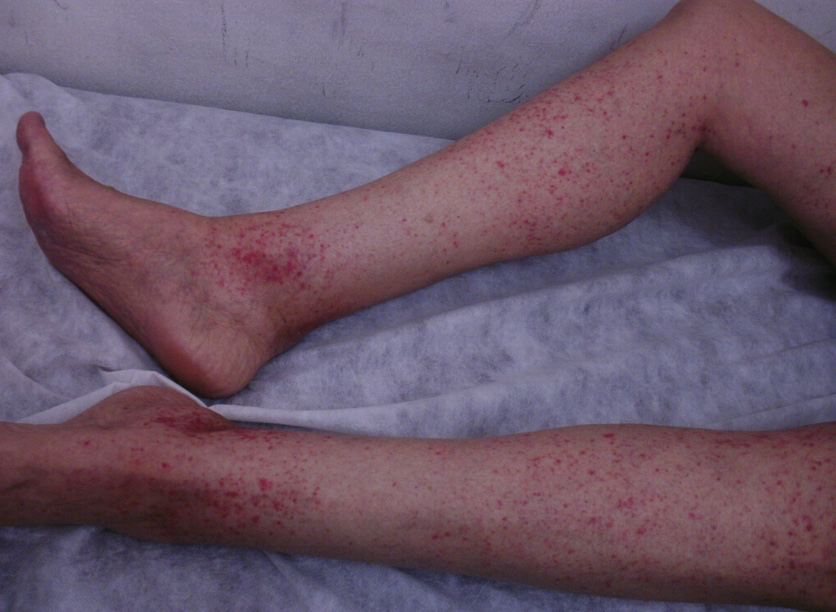
Foto 1. Púrpura palpable
La púrpura de Schönlein Henoch suele seguir un curso leve, autolimitado con buen pronóstico, que dura entre 4 y 6 semanas en promedio. El episodio único es más común en la infancia temprana, pero las recurrencias pueden ocurrir en más del 40 % de los niños mayores de 7 años.
La biopsia de piel para técnica de inmunofluorescencia directa (IFD) debe realizarse en las primeras horas de la lesión (entre 6 a 24 horas) para evitar la fagocitosis de los complejos inmunes de IgA por fagocitos.
Diagnósticos diferenciales
- Eritema multiforme
- Otras vasculitis
- Edema agudo hemorrágico de la infancia (se presenta en niños de entre 4 meses y 2 años de edad, con antecedente de infección de vías respiratorias, toma de antibióticos o vacunación previos. Son típicas las lesiones «en cocarda», anulares, llamativas, por lo que el diagnóstico es clínico. Hay compromiso de la cara, fiebre, buen estado general y dura de 1 a 3 semanas. La IFD no demuestra depósito de IgA).
Terapéutica
Los chicos con hematuria microscópica no persistente y leve, sin disfunción renal o proteinuria, no requieren terapéutica esteroidea, sino solo efectuar control con sedimento urinario fresco y tratamiento sintomático. Aquellos con proteinuria más severa o alteración del filtrado glomerular y proteinuria persistente, requieren la consulta con el nefrólogo y biopsia renal. El tratamiento contempla corticoides orales y/o pulsos de metilprednisolona. Si hay compromiso renal moderado, se utilizan inmunosupresores: la azatioprina o el mofetil micofenolato se consideran de segunda línea. Para los más severos, se utiliza ciclofosfamida endovenosa combinada con corticoides orales y antihipertensivos.
Los corticoides no previenen la afectación renal, pero su administración temprana mejora el curso de esta afectación.
Urticaria vasculitis
Es una vasculitis leucocitoclástica de vasos pequeños que asocia lesiones y mecanismos de urticaria y vasculitis. Se caracteriza por la presencia de pápulas o placas que duran de 48 a 72 horas y se acompañan de dolor o ardor, además de prurito. En miembros inferiores, suelen tener livedo reticular y petequias.
La urticaria vasculitis puede ser normocomplementémica o hipocomplementémica. Esta última acompaña enfermedades autoinmunes (LES, Sjögren, AR, Hashimoto o Graves-Basedow), infecciosas, linfomas, paraneoplasias y erupciones por fármacos.
La urticaria vasculitis evoluciona por brotes en forma crónica. Puede comprometer pulmón y riñón, generalmente en forma leve. Se suma en ocasiones el angioedema.
En la urticaria vasculitis intervienen anticuerpos anti-C1q, los cuales producen hipocomplementemia C4 y C1q.
Tratamiento
El tratamiento depende de la enfermedad de base. Particularmente, en la superposición lupus eritematoso sistémico (LES)-Sjögren, el compromiso puede ser más severo, los infiltrados inflamatorios exhiben abundante leucocitoclasia con eosinófilos; además, se asocia a crioglobulinemia, anticuerpos Ro y La+, y compromiso neurológico periférico, central o de ambos.
Vasculitis crioglobulinémica
Se trata de una vasculitis leucocitoclástica de vasos pequeños. En presencia de crioglobulinemia tipo II (con componente monoclonal IgM y policlonal IgG) y III (policlonal), Ac antifosfolípido o anticitoplasma de neutrófilos (ANCA), la vasculitis suele asociarse a procesos sistémicos (linfomas, HVB y HVC, colagenopatías, paraneoplasias).
La crioglobulinemia tipo I causa una vasculopatía oclusiva con trombos homogéneos que ocluyen los vasos pequeños con presencia de IgM monoclonal; se ve en la macroglobulinemia de Waldenström y el mieloma múltiple. No es una verdadera vasculitis, ya que no tiene ningún fenómeno inflamatorio.
El compromiso cutáneo puede asociarse a artralgias, neuropatía periférica, hepatitis crónica, cirrosis y glomerulonefritis. La terapéutica dependerá del proceso asociado.
Vasculitis en Sjögren
En esta vasculitis leucocitoclástica de vasos pequeños, el compromiso cutáneo se ha detectado en el 16 % de los pacientes, con vasculitis en más del 50 %. Predomina la vasculitis de vasos pequeños y hay enfermedad inmunológica. Clínicamente, se manifiesta como púrpura palpable, lesiones urticarianas o máculas anulares y púrpura hiperglobulinémica de Waldenström (benigna, en miembros inferiores y plantas, transitoria, relacionada con la bipedestación prolongada y ejercicios violentos).
Los pacientes con vasculitis cutánea tienen mayor prevalencia de compromiso articular, neuropatía periférica, Raynaud, compromiso renal, ANA, FR, anti-Ro/SS-A positivos y hospitalización, en comparación con pacientes con SS sin vasculitis.
Enfermedad de Behçet
Esta vasculitis leucocitoclástica de vasos pequeños se caracteriza por la aparición de aftas orales recurrentes, aftas genitales y compromiso oftálmico que puede llevar a la ceguera. Es más frecuente en individuos provenientes de Turquía y zonas que rodean el Mediterráneo. Puede iniciarse en la infancia.
Se desconoce su etiopatogenia, pero hay alta prevalencia de HLA-B51 y antecedentes familiares. Estos son los criterios diagnósticos:
Criterio mayor: aftas orales recurrentes (al menos tres episodios por año)
Criterios menores:
- Uveítis (anterior, posterior, células en el humor vítreo)
- Aftas genitales
- Cutáneos: eritema nudoso, foliculitis crónica recurrente, erupción acneiforme (es polimorfa) en tronco, fenómeno de patergia (aparición de lesiones en sitio de trauma)
- Histología (HP): infiltrados neutrofílicos
- HLA-B51
El estudio HP puede mostrar granulomas extravasculares con eosinófilos tipo Churg Strauss.
El compromiso genital es el más frecuente. Puede existir compromiso de órganos: SNC (parenquimatoso o vascular por trombosis arterial o venosa) o SNP, pulmonar, hepático o intestinal. El compromiso vascular incluye aneurismas de arterias medianas que se confirman por angiografía por resonancia magnética (RMN). Puede iniciarse con artritis de miembros inferiores. Una complicación muy rara es el infarto de miocardio con 3 % de mortalidad. Son de mal pronóstico la encefalopatía, la uveítis severa y la trombosis venosa múltiple.
Vasculitis asociadas a anticuerpos anticitoplasma de neutrófilos
Es una vasculitis leucocitoclástica de vasos pequeños. Las vasculitis asociadas a ANCA (AAV o VAA, por su sigla en inglés) presentan Ac contra proteinasa 3 (PR3-AAV, o ANCAc) o mieloperoxidasa (MPO-AAV, o ANCAp). Son sistémicas. Las diferencias entre ambas son etiológicas y fisiopatológicas.
La PR3-AAV es más común en el norte del mundo, mientras que el MPO-AAV es más común en las regiones del sur de Europa, Asia y el Pacífico, con la excepción de Nueva Zelanda y Australia. Existe una alta prevalencia del alelo HLA-DPB1*04:01 en pacientes con PR3-AAV, en comparación con pacientes con MPO-AAV y/o controles sanos. Clínicamente, ambos serotipos son difíciles de distinguir, pero en las PR3-AAV se ven afectados varios órganos, mientras que en las MPO-AAV, la vasculitis renal limitada ocurre con mayor frecuencia.
Los Ac anti-MPO (ANCAp+) con patrón perinuclear se hallan en la llamada «poliangitis microscópica» (PAM) de vasos pequeños con síndrome corazón-pulmón y en la poliangitis granulomatosa con eosinófilos (angeítis granulomatosa de Churg Strauss) sin síndrome corazón-pulmón, en alrededor del 80 % de los casos.
Los Ac PR3 ANCAc (patrón central) se dan en la granulomatosis con poliangitis (granulomatosis de Wegener), con especificidad y sensibilidad del 90 %.
Los ANCAp están presentes en otras enfermedades inflamatorias crónicas, como AR, síndrome de Felty, colitis ulcerosa crónica, hepatitis crónica, cirrosis biliar primaria, colangitis esclerosante, síndrome de Sweet y adictos a drogas, entre otras.
Existen tres formas clínicas de las vasculitis asociadas a ANCA:
- Granulomatosis con poliangitis (GPA) asociadas a PR3-ANCA
- Poliangitis microscópica asociada a MPO-ANCA y afectación de un órgano
- Granulomatosis eosinofílica con poliangitis (EGPA); antes Churg Strauss
Estos son los criterios (de 3 de 6) para la clasificación de la GPA (granulomatosis de Wegener):
- Orina anormal (glomerulonefritis pauciinmune en biopsia)
- Inflamación granulomatosa (biopsia)
- Inflamación de senos paranasales (Rx)
- Estenosis endobronquial, subglótica, traqueal
- Rx de tórax o TC anormal
- ANCAc+ (mortalidad del 15 %)
En los niños, la GPA se inicia en piel, en un 50 %, con ulceración necrótica perianal que avanza hacia el recto, deformidad nasal, proptosis por pseudotumor periorbitario, ulceración del paladar, hiperplasia gingival con petequias. Es una forma de lenta evolución con necrosis digital y facial.
La granulomatosis eosinofílica con poliangitis o granulomatosis de Churg Strauss incluye historia de asma, eosinofilia, afección pulmonar, GI y cutánea. La afectación cardíaca es causa de muerte. Además, presenta eosinofilia periférica, ANCAp+ o anti-MPO en el 30 a 70 % de los casos.
La mayoría de los pacientes con AAV son diagnosticados entre los 50 y 70 años, sin diferencias claras entre los serotipos de ANCA.
Las vasculitis asociadas a ANCA (AAV) son una enfermedad sistémica que involucra oído, nariz y garganta, pulmones, riñones, corazón, sistema digestivo, sistema nervioso, ojos, piel, aparato musculoesquelético y, con poca frecuencia, otros órganos.
Las características clínicas difieren entre la PR3-AAV (ANCAc) y la MPO-AAV (ANCAp):
- Hay una mayor frecuencia de la ANCAc+, que combina afectación del tracto respiratorio superior y/o inferior con el compromiso renal.
- La enfermedad renal es común en el AAV (80 %) y la prevalencia general no difiere entre la PR3-AAV y la MPO-AAV.
- La vasculitis está limitada al riñón en la ANCAp.
- La función renal está más gravemente afectada en la ANCAp.
- La frecuencia de afectación pulmonar es similar en ambos serotipos (pero lesiones fibrosantes e infiltrados irregulares son más frecuentes en la ANCAp, mientras que lesiones de cavitación, nódulos y masas en la radiografía de tórax se ven en la ANCAc+).
- La afectación de oído, nariz y garganta con lesiones necrotizantes se ve en la en ANCAc.
- En la ANCAp+ se ven pólipos y es rara la inflamación granulomatosa.
- Entre el 20 y 40 % de las AAV se presenta con lesiones cutáneas.
- Es raro arribar al diagnóstico a través de la biopsia de piel; el diagnóstico se realiza a través del hallazgo de granulomas por la afectación pulmonar.
- La afectación cardíaca en las AAV parece similar en ambos serotipos ANCA, salvo en la EGPA.
- Las manifestaciones oftalmológicas, como la enfermedad inflamatoria orbitaria, se observan con mayor frecuencia en la ANCAc (PR3).
- La histología renal muestra anomalías similares: glomerulonefritis necrotizante crescenti (NCGN, por su sigla en inglés) con necrosis fibrinoide en la microscopía óptica en combinación con pauciinmunidad (<2+ en escala de 0 a 4+) en IFD. Hay cuatro grupos: focal (>50 % glomérulos normales), creciente (>50 % glomérulos con crecientes celulares), esclerótica (50 % glomérulos esclerosados), mixta. Pronóstico: mejor supervivencia en focal, peor en esclerótica.
- Mayor frecuencia de recaídas en la ANCAc: supervivencia determinada por el desarrollo de hemorragia alveolar difusa en su presentación y recaídas renales.
- Supervivencia en ANCAp relacionada con enfermedad latente que lleva a compromiso renal en etapa terminal.
Tratamiento de las vasculitis asociadas a ANCA
Según la severidad y la extensión, la enfermedad se divide en tres grupos: localizada, temprana o ambas; generalizada, con compromiso de órgano; severa, con riesgo de muerte que compromete la vida.
- Enfermedad localizada y temprana: CYC (ciclofosfamida) o MTX (metotrexato). Con terapias estándar, 50 % de recaída a 5 años en enfermedad recientemente diagnosticada.
Progresión, recaída o la enfermedad localizada que causa destrucción notable: CYC es de elección. - Enfermedad generalizada, con compromiso de órgano: CYC y corticoides inicial.
Tanto en la enfermedad generalizada como en la localizada, se observa lo siguiente:
- Mantenimiento luego de remisión exitosa: dejar CYC y agregar MTX o azatioprina. El mantenimiento debiera continuar por un mínimo de 24 meses. Se recomienda continuar hasta 5 años en pacientes que permanecen ANCA positivos.
- Enfermedad refractaria: infliximab, inmunoglobulinas EV, rituximab (los pacientes PR3+ pueden responder mejor al rituximab que a la ciclofosfamida).
- Refractarios persistentes: investigar infecciones o malignidad.
- Factores de riesgo de recaída: afectación de oído, nariz y garganta, transporte nasal de S. aureus en PR3-AAV, afectación cardiovascular y aumento de títulos de ANCA con afectación renal.
- Supervivencia: ha mejorado de manera sustancial en las últimas tres décadas, mortalidad 2-30 % al año y 19-50 % a los 5 años (según afectación renal y/o la edad de inicio).
- Riesgo de muerte: dentro del primer año del diagnóstico, la infección es el riesgo más importante. A partir de entonces, las enfermedades cardiovasculares (el 14 % a 5 años, superior en la ANCAp+), tumores malignos e infecciones.
Vasculitis de vasos medianos
Vasculitis reumatoide
Afecta a vasos pequeños y medianos. Aparece tardíamente, 10 o 15 años después del inicio de la AR, y en las últimas décadas ha disminuido su frecuencia por el tratamiento precoz y más efectivo de la enfermedad.
La vasculitis reumatoide severa tiene una mortalidad a 5 años del 40 % a pesar de los tratamientos agresivos. Afecta la piel en el 90 %, con úlceras maleolares muy dolorosas, SNC y periférico (mononeuritis múltiple, neuropatía axonal), pulmón (hemorragia alveolar), riñón (glomerulonefritis necrotizante), ojo (epiescleritis, queratitis ulcerativa), intestino (colitis isquémica, gangrena). Son factores predisponentes altos títulos de FR y ACPA (Ac antipéptidos citrulinados), cigarrillo, sexo masculino, HLA DRB1.04/04, uso de terapias biológicas.
Tratamiento de la vasculitis reumatoide severa
Descartar vasculitis crioglobulinémica, infección por HVC o HIV, AAV por drogas (anti-TNFα, tocilizumab). Se indican corticoides, de 0,5 a 1 mg/kg/día, azatioprina, ciclofosfamida, metotrexato. De acuerdo con la extensión y la severidad de la enfermedad, si no hay respuesta, se puede tratar con anti-TNFα (también pueden inducirla), rituximab (las tres cuartas partes de los pacientes responden y remiten), tocilizumab en VR sistémica con glomerulonefritis necrotizante creciente.
Poliarteritis nudosa o panarteritis nodosa
Poliarteritis nudosa cutánea (cutis)
Afecta a niños y adultos, con dos picos de incidencia: entre los 11 y 15 años, y entre los 50 y 60 años.
Clínicamente, se caracteriza por livedo reticular y/o racemoso con nódulos palpables en su trayecto (fotos 2 y 3) y afecta, predominantemente, miembros inferiores, palmas y plantas. Se acompaña de artralgias y mialgias importantes, y cursa por brotes con cierta cronicidad. No afecta el estado general ni otros órganos, pero requiere tratamiento sistémico por la sintomatología general y la polineuropatía que puede acompañar el cuadro. Puede haber ulceración y lesiones necróticas en el trayecto del livedo, aun en la forma cutánea pura.
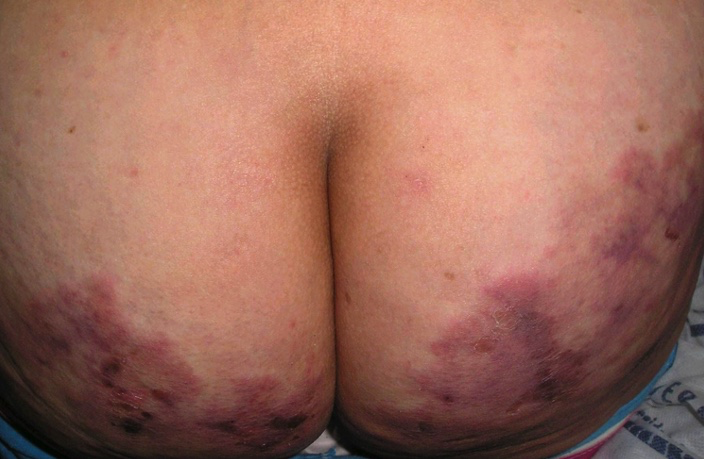
Foto 2. Livedo racemoso ulcerado en PAN (glúteo)
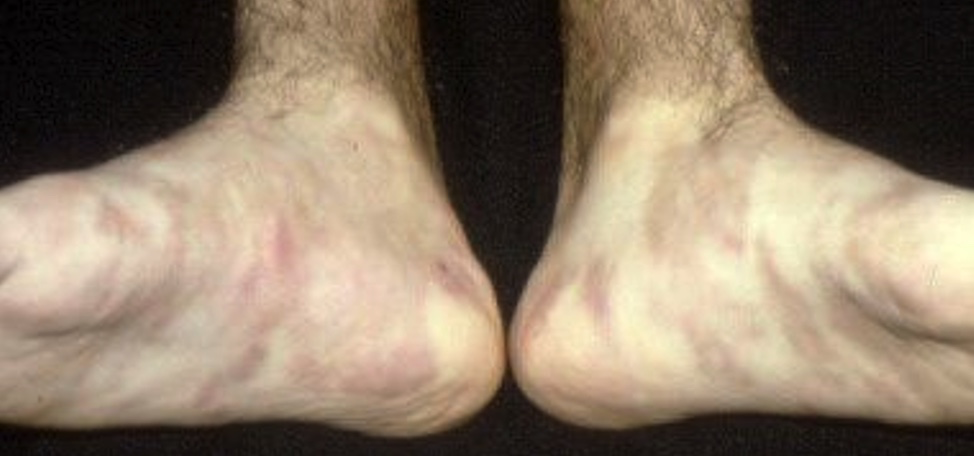
Foto 3. Nódulos sobre livedo reticular en PAN cutánea, en pie de un niño (típico)
Diagnóstico diferencial
En las vasculitis en adictos a drogas (marihuana, cocaína, inyectable o aspirada), las lesiones pueden ser indistinguibles clínica e histológicamente de la forma idiopática. La llamada «arteritis cannavis» fue descripta en 1960 como arteritis obliterante, símil tromboangeítis obliterante en jóvenes fumadores de marihuana. Distal o proximal, produce necrosis distal en fumadores empedernidos. Puede acompañarse del fenómeno de Raynaud, es obliterante con vasculitis tipo PAN o tromboangeítis obliterante (TAO). Mejora al dejar el hábito y empeora al reincidir. Puede comprometer el cerebro y corazón o llevar a la amputación distal. En 2011 se describió la púrpura retiforme con necrosis cutánea por cocaína adulterada con levamisol.
La HP de la PAN muestra la afectación de toda la pared del vaso con una angeítis leucocitoclástica con oclusión. Debido a que compromete vasos de mediano calibre en la hipodermis, la biopsia debe ser profunda, en lo posible por losange. En vasos más superficiales y pequeños, puede presentar una angeítis de pequeño vaso que no es diagnóstica.
Si bien parece existir una relación entre las formas cutáneas y sistémicas, no se conoce la evolución de una a otra forma clínica.
La PAN cutánea requiere un tratamiento menos agresivo, basado en antiinflamatorios no esteroides, en cortos períodos de tiempo. No obstante, la intensidad del dolor puede requerir la administración de dosis bajas de corticoides inicialmente y puede evolucionar con brotes. Para la PAN asociada a HVB, hay diferentes esquemas, centrados en el uso de antivirales para controlar la infección.
Poliarteritis nudosa sistémica idiopática
Es una enfermedad severa con deterioro rápido del estado general, fiebre, diarrea y adelgazamiento notable. Puede acompañarse también de miositis, polineuritis, mononeuritis, artralgias, livedo reticular o racemoso (notables en la región glútea o la maleolar), ulceraciones cutáneas y lesiones necróticas. Compromete riñón y corazón, con formación de aneurismas, similar a la enfermedad de Kawasaki. Cuando no se observen nódulos cutáneos, se puede recurrir a la biopsia del nervio sural (sensitivo), donde se observa el compromiso con pérdida de fibras nerviosas amielínicas más finas.
La ecografía (cardíaca y renal, ya que los órganos más afectados son el corazón y el riñón), la TAC y la RMN confirman el diagnóstico.
Tratamiento
Se indica una combinación de corticoides y ciclofosfamida EV en casos severos. En aquellos resistentes a la ciclofosfamida, se han reportado casos donde se administraron anti-TNFα, rituximab y mofetil micofenolato.
Enfermedad de Kawasaki (síndrome mucocutáneo ganglionar)
Los primeros casos se describieron en Japón, en 1967. Es una vasculitis sistémica de arterias de mediano calibre y constituye la causa más frecuente de enfermedad cardíaca adquirida en niños en los Estados Unidos: un tercio de ellos desarrolla enfermedad coronaria facilitada por la demora diagnóstica. En ese país, su incidencia es de 5,95/100.000, y en Japón, de 90/100.000. En la población hispana, la incidencia es menor. Los asiáticos y afrocaribeños son quienes tienen mayor riesgo.
La etiopatogenia es multifactorial (susceptibilidad: genética, clima, raza, factores socioeconómicos, origen asiático, clima frío y húmedo, infecciones por estreptococo y estafilococo que actuarían como superantígenos).
Aparece en niños menores de 5 años (es más frecuente y severa en menores de 1 año). Se presenta con fiebre de al menos 5 días de duración, irritabilidad, inyección conjuntival y adenopatía submaxilar. Se observa eritema de labios, lengua, faringe, eritema purpúrico plantar, edema de extremidades o del área perineal y exantema polimorfo. Las palmas y plantas presentan una descamación característica después de unos días, además de la descamación periungueal. Son notables las adenopatías cervicales. El eritema y la induración son característicos en los sitios de inmunización con BCG.
Afecta selectivamente las arterias coronarias, con aneurismas que son visibles mediante ecocardiografía o angiografía coronaria en el 25 % de los casos. La mortalidad es del 1 % (asciende al 35 % cuando hay complicaciones cardiovasculares). Los aneurismas coronarios son más frecuentes en menores de 1 año, están relacionados con hiperplaquetosis y fiebre, y empeoran el pronóstico; el tratamiento precoz apunta a prevenirlos, ya que son causa de mortalidad.
En cuanto al laboratorio, no es específico: eritrosedimentación elevada, leucocitosis, hiperplaquetosis y anemia (reactantes de fase aguda). El monitoreo se realiza con ECG (arritmias, isquemia, disfunción miocárdica), ecocardiografía bidimensional y angiografía coronaria selectiva (para evaluar el tamaño de los aneurismas). Si hay dolor abdominal agudo inicial, están indicados la ecografía abdominal y el examen de sangre oculta en materia fecal, porque la intususcepción intestinal puede ser una complicación.
Tratamiento estándar
Se indica γ-globulina EV en una dosis de 2 g/kg/día, durante 3 a 5 días. Aspirina: de 50 a 80 mg/kg aproximadamente durante 6 semanas; luego de 3 a 5 mg/kg hasta la normalización de plaquetas y eritrosedimentación.
En casos refractarios, infliximab, pulsos de prednisolona, ciclosporina. Si hay aneurismas de gran tamaño, se debe instaurar la anticoagulación.
Vasculitis de vasos grandes
Arteritis de Takayasu
Es de etiología autoinmune. Produce estenosis y dilatación aneurismática segmentaria de grandes vasos: aorta y sus ramas, en especial carótida y cerebrales. Es más frecuente en mujeres jóvenes, se inicia antes de los 19 años en el 20 % de los casos y puede verse en niños.
Clínicamente, se caracteriza por fiebre, sudoración nocturna, anorexia, pérdida de peso y artritis; en el laboratorio, hay presencia de reactantes de fase aguda. Por esta razón, deben descartarse procesos infecciosos (virales, TBC), especialmente en países de Oriente, donde es más frecuente.
En el 100 % de los casos, está afectada la aorta abdominal (se detecta por RMN); en el 86 %, las arterias renales; en el 50 %, la aorta torácica; en el 28,5 %, las arterias pulmonares, y en el 57,1 %, las arterias gastrointestinales.
Estos son los criterios diagnósticos:
- Criterio mayor: anomalías angiográficas de la aorta o sus ramas mayores (angiorresonancia ARM, PET, TAC)
- Criterios menores (al menos uno)
- Disminución de pulsos periféricos y/o claudicación de extremidades
- Diferencia de TA mayor de 10 mmHg entre uno y otro miembro superior
- Frémito aórtico o sobre sus ramas
- Hipertensión (35 % de mortalidad asociada)
Tratamiento
Se indican corticoides, ciclofosfamida (CYC) en pulsos, agentes biológicos, MTX, azatioprina, MMF como primera o segunda línea. Ante la remisión, después de la CYC EV, se pasa a terapéutica de mantenimiento con otros agentes inmunosupresores.
Si hay enfermedad renal severa o hemorragia pulmonar, se indican CYC y esteroides con plasmaféresis como adyuvante.
Arteritis de células gigantes. Arteritis temporal. Enfermedad de Horton
Se observa en mayores de 50 años con predominio femenino (2-3:1). Existe compromiso de arterias medianas o grandes en forma segmentaria, uni o bilateral. Puede afectar vasos craneales (se la denomina «temporal» porque afecta la arteria del mismo nombre) o extracraneales. Hay predisposición genética poligénica y asociación con HLA DRB1.04.
Se inicia con dolor local, cefalea, fiebre y prominencia de la arteria afectada, con disminución del pulso y endurecimiento a la palpación. Se asocia a artralgias, mialgias, rigidez y dolor en el cuello y la parte superior de la espalda, articulación temporomandibular y molares (polimialgia reumática) o es precedido por estas afecciones. El diagnóstico se demora más en la forma extracraneal (en promedio, 5 años) y se ven afectadas, en especial, ramas de la aorta.
Hay entre un 15 y 30 % de complicación oclusiva de arterias epicraneales y puede ocasionar ceguera transitoria o definitiva. La eritrosedimentación de 50 mm o más/h, anemia y PCR elevada son parte del cuadro en actividad.
Su confirmación requiere la biopsia de la arteria temporal o el estudio de imágenes por personal entrenado. Durante la enfermedad activa, estudios de imágenes —en especial, la ecografía doppler color bidimensional— pueden evitar la biopsia: se observa el «signo del halo» por engrosamiento de la pared vascular. Para detectar el compromiso extracraneal, se indican PET-TAC y RMN en busca de dilataciones o estrecheces segmentarias de la aorta y sus ramas.
La HP demuestra granulomas con células gigantes y ruptura de fibras elásticas de la lámina interna del vaso por el infiltrado inflamatorio, con afectación de endotelios que conducen a fibrosis y oclusión, todo lo cual causa los cuadros isquémicos.
Tratamiento
Se indican corticoides en dosis de 1 mg/kg/día, con disminución progresiva. Se requiere mantenimiento para evitar recidivas y asociar tratamiento sintomático. Debe ser precoz (los cambios diagnósticos se pueden ver aun después de 5 días a 2 semanas de la corticoterapia).
Estudio de las vasculitis cutáneas y sistémicas
Los estudios varían de acuerdo con el caso:
- Cuadro cutáneo puro, autolimitado (3 semanas), sin afectación del estado general
- Cuadro persistente, con compromiso general
Para ambos cuadros, debe estudiarse lo siguiente:
- Anamnesis: antecedente de uso de drogas orales, inyectables, aspiradas
- Exposición a fármacos, sílice o pesticidas
- Examen físico: por aparatos y sistemas (piel, cardiovascular, otros órganos)
- Estudio de órganos y aparatos sintomáticos (cardiovascular, pulmonar, renal, ORL, ocular)
- Laboratorio: hemograma y eritrosedimentación, recuento de plaquetas y fórmula leucocitaria, hepatograma, proteinograma, crioglobulinas, Ac antifosfolípido (optativo). Sedimento urinario, clearance de creatinina, sangre oculta en materia fecal. Hisopado nasal y faríngeo
- Imágenes: Rx tórax. Ecografía abdominal
Para cuadro persistente, con compromiso general, hay que descartar lo siguiente:
- Patología infecciosa viral, bacteriana o micosis profundas. Serología para HVB, HVC, VIH, parvovirus B19, micoplasma
- Ac enfermedades autoinmunes (Ro, La, ADN, ANA, FR, RNP y Sm, FR, APC, ASCA)
- Complemento hemolítico total, C3, C4, C1q
- Biopsia de piel o riñón para IFD en busca de IgA. Si es negativa, pedir ANCA por IFI y ELISA
Si los ANCA son positivos:
- Biopsia de tracto respiratorio superior para HP (granulomas)
Si los ANCA son negativos, según caso y localización de síntomas:
- Biopsia de arteria temporal (bilateral de ser posible)
- Ecografía doppler color bidimensional
- TAC alta resolución, TAC-PET, RMN
Puntos clave
- Las vasculitis pueden ser procesos cutáneos o sistémicos, con diferentes mecanismos implicados y en respuesta a múltiples etiologías (no solo las autoinmunes), que incluyen causas infecciosas y medicamentosas.
- El calibre de los vasos afectados es importante y constituye la base de su clasificación. Clínicamente, se caracterizan en la piel por la púrpura palpable.
- Cuando el proceso dura más de un mes, merece estudio sistemático.
- El algoritmo de estudio se inicia con la búsqueda de depósitos de IgA en biopsias de lesiones tempranas de piel para descartar la púrpura anafilactoide de Schönlein Henoch (vasculitis por IgA), que es una de las más frecuentes.
- El laboratorio no es específico, salvo la presencia de anticuerpos ANCA que caracterizan al grupo de vasculitis ANCA positivas. Son un importante ítem del algoritmo diagnóstico: PR3-AAV (ANCAc) y
MPO-AAV (ANCAp).- En las vasculitis de grandes vasos (arteritis de Horton y Takayasu), los estudios de imágenes juegan un rol importante en el diagnóstico (además de la biopsia de arteria temporal en la primera).
- Las colagenopatías se asocian con frecuencia a vasculitis, como la urticaria vasculítica en su forma hipocomplementémica.
- En la elección del tratamiento, es fundamental conocer la existencia y el grado de compromiso sistémico.
- Las PAN, al igual que la vasculitis reumatoide, pueden ser cutáneas o sistémicas. Cuando son sistémicas, tienen compromiso general severo y deben tratarse con corticoides, inmunosupresores o medicamentos biológicos, de acuerdo con su respuesta.
Bibliografía recomendada
Jennette JC, Falk RJ, Bacon PA, Basu N, et al. 2012 Revised International Chapel Hill Consensus Conference Nomenclature of Vasculitides. Arthritis Rheum. 2013;65:1-11.
Aras, G. Recent aspects and future directions. Intern Med. 2011;50:1868-1877.
Waller JM, et al. Cocaine-induced retiform purpura and neutropenia is levamisole the culprit? J Am Acad Dermatol. 2010,63:530-535
Eleftheriou D, Brogan PA. Therapeutic advances in the treatment of vasculitis. Pediatric Rheumatology 2016; 14:26.
Brogan P, Eleftheriou P, Dillon M. Small vessel vasculitis. Pediatr Nephrol. 2010;25(6):1025-1035.
Hassan ML, Pérez Cejudo S, Yacci del Pino V, Schroh R. Urticaria vasculítica. Estudio de 12 casos. Med Cut LA. 1990;19:179-184.
Hassan ML, Fejes M, Riera M y Reyes M. Urticaria vasculítica, angioedema adquirido y enfermedad tiroidea autoinmune. Rev Arg Derm. 1984;65:84-94. (Estudio de 12 miembros de una familia).
Mazzaro C. et al. Hepatitis B virus related cryoglobulinemic vasculitis: A multicentre open label study from the Gruppo Italiano di Studio delle Crioglobulinemie (GISC). Dig Liver Dis. 2016 Jul;48(7):780-784.
Hassan ML, Colagenopatías en Dermatología. Con enfoque multidisciplinario. Buenos Aires: Akadia; 2017. Cap. 10, pp. 267-269.
Muñoz SA, Orden AO, Kostianovsky A, Pisoni CN, et al. The HLA-B*51 Allele Is Strongly Associated With Behçet Disease in an Argentinean Population. Reumatol Clin. 2018 Aug 6. pii: S1699-258X (18)30134-7. [Epub ahead of print].
Rodríguez Carballeira M, Espinosa Garriga G. Enfermedad de Behçet: concepto y epidemiología. Cuadernos de Autoinmunidad. 2011;9:1-9.
Newburger JW y Fulton DR. Kawasaki disease. Curr Treat Options Cardiovasc Med. 2007;9:148-158.
Brogan P, Eleftheriou D. Vasculitis update. Pathogenesis and biomarkers. Pediatr Nephrol. 2018 Feb;33(2):187-198.
Hillhorst M, Van Paassen P y Cohen Tervaert JW. Proteinase 3-ANCA Vasculitis versus Myeloperoxidase-ANCA Vasculitis. J Am Soc Nephrol. 2015 Oct;26(10):2314-2327.
Sharma A, et al. Connective tissue disorder-Associated Vasculitis. Curr Rheumatol Rep. 2016;18(6):31.
Puéchal X, Gottenberg JE, Berthelot JM, Gossec L, et al. Investigators of the AutoImmunity Rituximab Registry. Rituximab therapy for systemic vasculitis associated with rheumatoid arthritis: Results from the AutoImmunity and Rituximab Registry. Arthr Care Res (Hoboken). 2012;64:331-339.
Yazici Y. Systemic vasculitis treatment and monitoring update 2008. Bulletin of the NYU Hospital for Joint Diseases. 2008;66(3):228-230.
Hassan ML, Baldrich A, Mugico B, del Castillo MRP, Stengel F. Periarteritis nudosa predominantemente cutánea. Consideraciones a propósito del estudio de dos casos. Revisión del tema. Rev Arg Derm. 1990;71:48-57.
Fatalla BM, Miller L, Brady S, Schaller JG. Cutaneous polyarteritis nodosa in children. J Am Acad Dermatol. 2005;53:724-728.
Hassan ML, Moreno Figueredo A, Gamallo A, Corbella C. Arteritis Cannavis. Prensa Med Arg. 2008;95:652-658.
González Gay MA, Ortego Jurago M, Ercole L y Ortego Centeno N. Giant cell arteritis: is the clinical spectrum of the disease changing? BMC Geriatr. 2019;19:200.
Pastor Martínez R, Gallardo Padilla M, Peña González LP, Gómez Grande A, de Inocencio Arocena J. Usefulness of the PET/CT scan in the diagnosis of short-segment Takayasu arteritis. An Pediatr (Barc). 2019 Jul;91(1):55-57.


