Los linfomas cutáneos primarios (LCP) se definen como linfomas no Hodgkin que se presentan en la piel sin evidencia de enfermedad extracutánea en el momento del diagnóstico.
Representan un grupo heterogéneo de entidades con pronóstico y características epidemiológicas, clínicas, histológicas y moleculares distintas. Son el segundo grupo en frecuencia de los linfomas extranodales, después de los linfomas gastrointestinales primarios.
Este grupo está compuesto por neoplasias, principalmente de linfocitos T y de linfocitos B, que tienen tropismo específico por la piel, y con menos frecuencia son proliferaciones de células NK (Natural Killer: asesinas naturales) y dendríticas plasmocitoides.
Los linfomas cutáneos primarios son enfermedades de baja incidencia, y a diferencia de lo que sucede con los linfomas sistémicos, las neoplasias cutáneas de células T son las más frecuentes.
Epidemiología
La incidencia anual de los linfomas cutáneos primarios en el mundo es de 0,5 a 1 por 100.000 habitantes. La tasa de incidencia en nuestro país es desconocida; sin embargo, en 2014 se reportó una incidencia aproximada de 0,5 a 0,8 por 100.000.
Los linfomas cutáneos de células T (LCCT) son los más frecuentes; una de sus variantes, la micosis fungoide (MF), da cuenta de entre el 50 y 65 % de ellos, mientras que el resto de los LCCT representan un 25 %. Los linfomas cutáneos tipo B (LCCB) conforman el 25 % restante.
Clasificación
La clasificación de los linfomas cutáneos primarios ha estado ligada a la de los linfomas sistémicos, hasta que la Organización Mundial de la Salud (WHO, por su sigla en inglés) y la Organización Europea para la Investigación y Tratamiento del Cáncer (EORTC) los clasificó, en el año 2005, separándolos del resto de las entidades.
Esta separación es importante para definir los linfomas cutáneos primarios debido a que la mayoría de ellos tienen un curso menos agresivo y requieren tratamientos menos complejos, dirigidos muchas veces solo a la piel.
Clasificación de WHO-EORTC
Linfomas cutáneos de células T (LCCT)
- Micosis fungoide (MF)
Variantes o subtipos de la MF:
-
- MF foliculotropa
- Reticulosis pagetoide
- Cutis laxa granulomatosa
- Síndrome de Sézary (SS)
- Desórdenes linfoproliferativos CD30+ cutáneos primarios
-
- Linfoma anaplásico de células grandes primariamente cutáneo
- Papulosis linfomatoide (LyP)
- Linfoma de células T subcutáneo símil paniculitis
- Linfoma de células T extranodal NK/T (Natural Killer), tipo nasal
- Linfomas T periféricos cutáneos primarios no especificados
- Linfoma T epidermotropo agresivo CD8+ (provisional)
- Linfoma T gamma/delta (provisional)
- Linfoma T pleomórfico de células pequeñas/medianas (provisional)
- Linfoma/leucemia de células T del adulto
Linfomas cutáneos de células B (LCCB)
- LCCB de la zona marginal
- LCCB centrofolicular
- LCCB difuso de células grandes, de la pierna
- LCCB difuso de células grandes, otro
- LCCB de células grandes intravascular
Neoplasia precursor hematológico
- Neoplasia hematodérmica CD4+/CD56+ (linfoma NK blástico)
Linfomas primarios cutáneos de células T (LCCT)
Los LCCT representan, aproximadamente, el 65 % de los linfomas cutáneos, la mayoría de bajo grado con un buen pronóstico.
Las manifestaciones clínicas suelen ser diversas y dependen del tipo de linfoma y su estadio. Algunas variantes, como la MF, tienen una historia natural de años de evolución y pueden confundirse con otras dermatosis, como la psoriasis o el eccema.
La etiopatogenia no es conocida; se la considera una enfermedad de estimulación antigénica crónica, con factores genéticos, infecciosos, ambientales e inmunológicos involucrados.
El diagnóstico se realiza correlacionando la clínica, la histopatología (fotos 1 y 2), la inmunohistoquímica y, si es posible, el examen de reordenamiento del receptor del linfocito T (TCR, por su sigla en inglés). En muchas ocasiones, es imprescindible la realización de varias biopsias para alcanzar el diagnóstico.
Micosis fungoide
Es la variante más frecuente de los linfomas cutáneos de células T: representa entre el 45 y el 65 % de ellos. En la Argentina, la frecuencia relativa es un poco más alta, cercana al 75 %. La edad media de presentación es 58 años, con predominio en los hombres. Es una enfermedad de larga evolución (años) y en estadios avanzados puede comprometer ganglios linfáticos, órganos internos y llevar a la muerte. El pronóstico está determinado por la edad y el estadio clínico. En los estadios tempranos, los pacientes tienen una expectativa de vida similar a la población general, por lo que es muy importante el diagnóstico en estos estadios.
Existen algunas situaciones que alteran el pronóstico favorable, tales como la variante foliculotropa, la transformación a células grandes CD30 positivas y los estadios avanzados.
La etiopatogenia no es conocida; se consideran, entre otros, como posibles factores implicados los genéticos, las infecciones virales, la estimulación antigénica crónica y persistente, y la posible relación con la exposición ambiental u ocupacional a productos químicos, metales, herbicidas, pesticidas.
La MF se manifiesta en su forma clásica como máculas, placas o tumores; algunos pacientes pueden presentar simultáneamente más de un tipo de lesión.
Las máculas son circulares u ovales, eritematosas o eritematoescamosas, de contornos bien definidos, distribuidas en tronco y raíz de miembros, principalmente en áreas no expuestas al sol, como caderas y zonas bajas del tronco (fotos 3 y 4). El prurito es variable. Estas lesiones pueden durar años y representan estadios tempranos de la enfermedad.
Las placas son lesiones sobreelevadas bien definidas, eritematosas, parduscas, expresión de infiltración de lesiones previas o de piel sana; pueden unirse y formar lesiones más grandes de configuración anular, arciforme o serpiginosa (fotos 5, 6 y 7). Raramente se necrosan.
Los tumores pueden aparecer en cualquier parte del cuerpo; su presencia en el rostro no es infrecuente. Son eritematosos, parduscos, de color rojo oscuro, y suelen ulcerarse (foto 8).
Tanto las placas como los tumores representan estadios más avanzados de la MF.
Se conocen variantes clínicas de la MF, las cuales presentan un cuadro clínico diferente, pero similar histopatología a la forma clásica. Debido a esta diversidad de formas clínicas que puede adoptar la MF, se la considera la gran simuladora. Algunas de ellas son las siguientes:
- MF hipopigmentada
- MF eritrodérmica
- MF poiquilodérmica
- MF ictiosiforme
- MF palmoplantar
- MF purpúrica
- MF papilomatosa
- MF papulosa
- MF solitaria o unilesional
- MF invisible
La histopatología varía de acuerdo con el tipo de lesión y el estadio de la MF.
Las máculas presentan infiltrados linfocitarios, liquenoides o perivasculares, con escasas células atípicas pequeñas a medianas, de núcleo cerebriforme y generalmente hipercrómico. Estas células atípicas pueden migrar a la epidermis, a menudo rodeadas por un halo claro, fenómeno conocido como «epidermotropismo».
Las placas muestran en dermis superior un infiltrado linfocitario denso, en banda. El epidermotropismo es más pronunciado; en ocasiones, puede observarse la presencia intraepidérmica de linfocitos atípicos agrupados, imagen conocida como «microabscesos de Pautrier».
Los tumores son infiltrados linfocitarios dérmicos difusos y profundos con mayor número de células atípicas, grandes, macrocarióticas, de núcleos cerebriformes. Se observa aquí pérdida del epidermotropismo.
Se conocen variantes histopatológicas de la MF, las cuales solo pueden diagnosticarse con la histopatología:
- MF granulomatosa
- MF intersticial
- MF transformada a células grandes
La MF es un linfoma de células T helper de memoria. Por esa razón, la inmunomarcación es CD3+, CD4+, CD45RO+. Además, pueden ser CD2+, CD5+, CD8-, TCR α/β+ y CD30-. En estadios avanzados, se puede presentar pérdida de algunos de estos antígenos de célula T. El patrón funcional de los linfocitos neoplásicos es Th2. En estadios tempranos, la inmunohistoquímica es útil, pero no imprescindible, para el diagnóstico.
La presencia de una población monoclonal de linfocitos T, determinada con el reordenamiento molecular del receptor de los linfocitos T (TCR), tiene valor en el diagnóstico, pero es poco sensible en estadios iniciales y puede encontrarse, además, en dermatosis benignas. El reordenamiento más frecuente es de las cadenas α/β del TCR (TCR a/b).
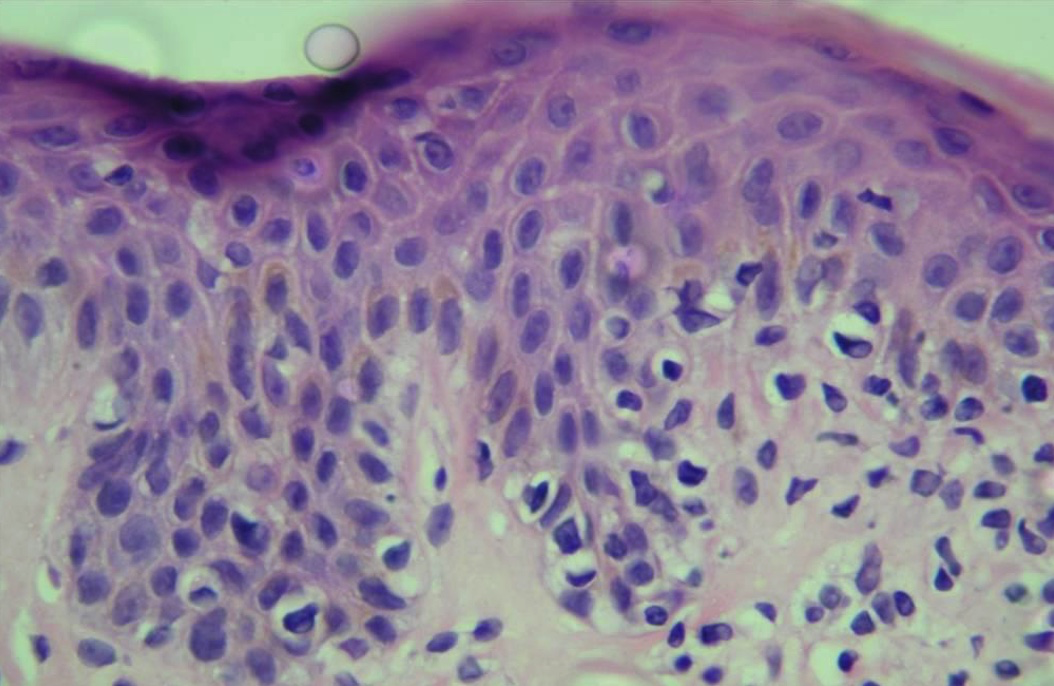 Foto 1. Histopatología. Micosis fungoide clásica
Foto 1. Histopatología. Micosis fungoide clásica
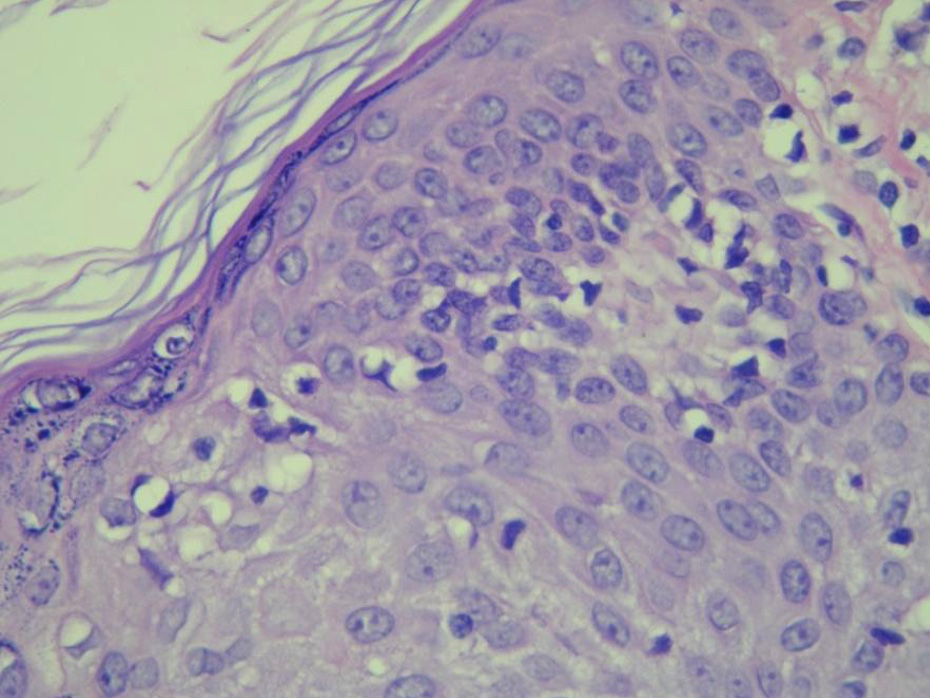
Foto 2. Histopatología. Micosis fungoide clásica
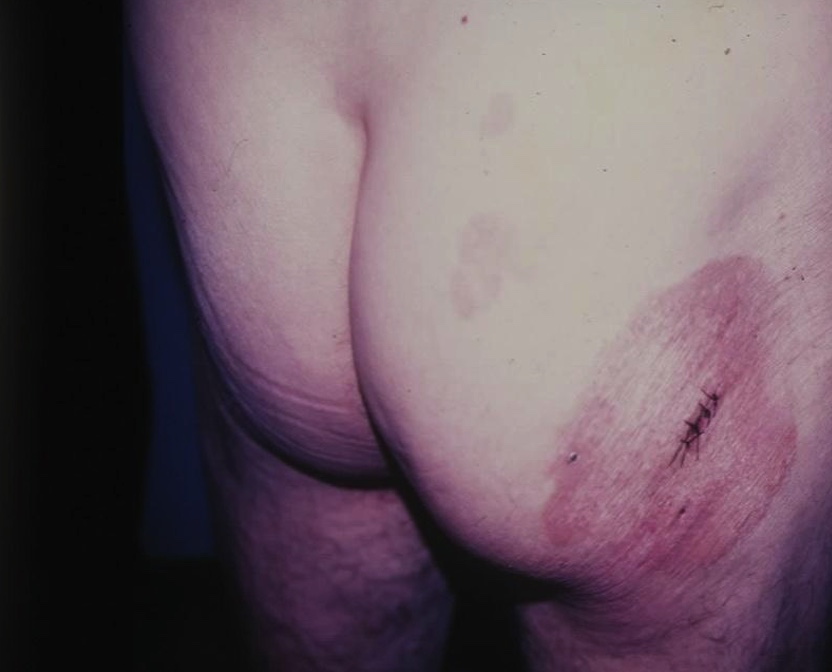
Foto 3. Micosis fungoide clásica clínica. Estadio mácula
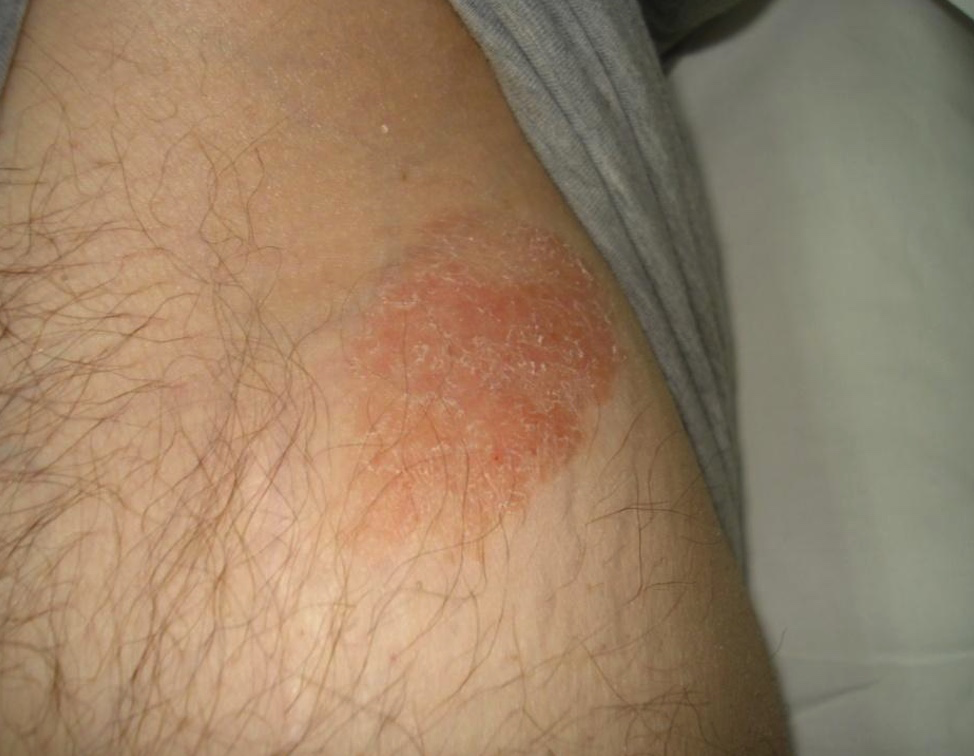
Foto 4. Micosis fungoide clásica clínica. Estadio mácula

Foto 5. Micosis fungoide clásica. Estadio de placa
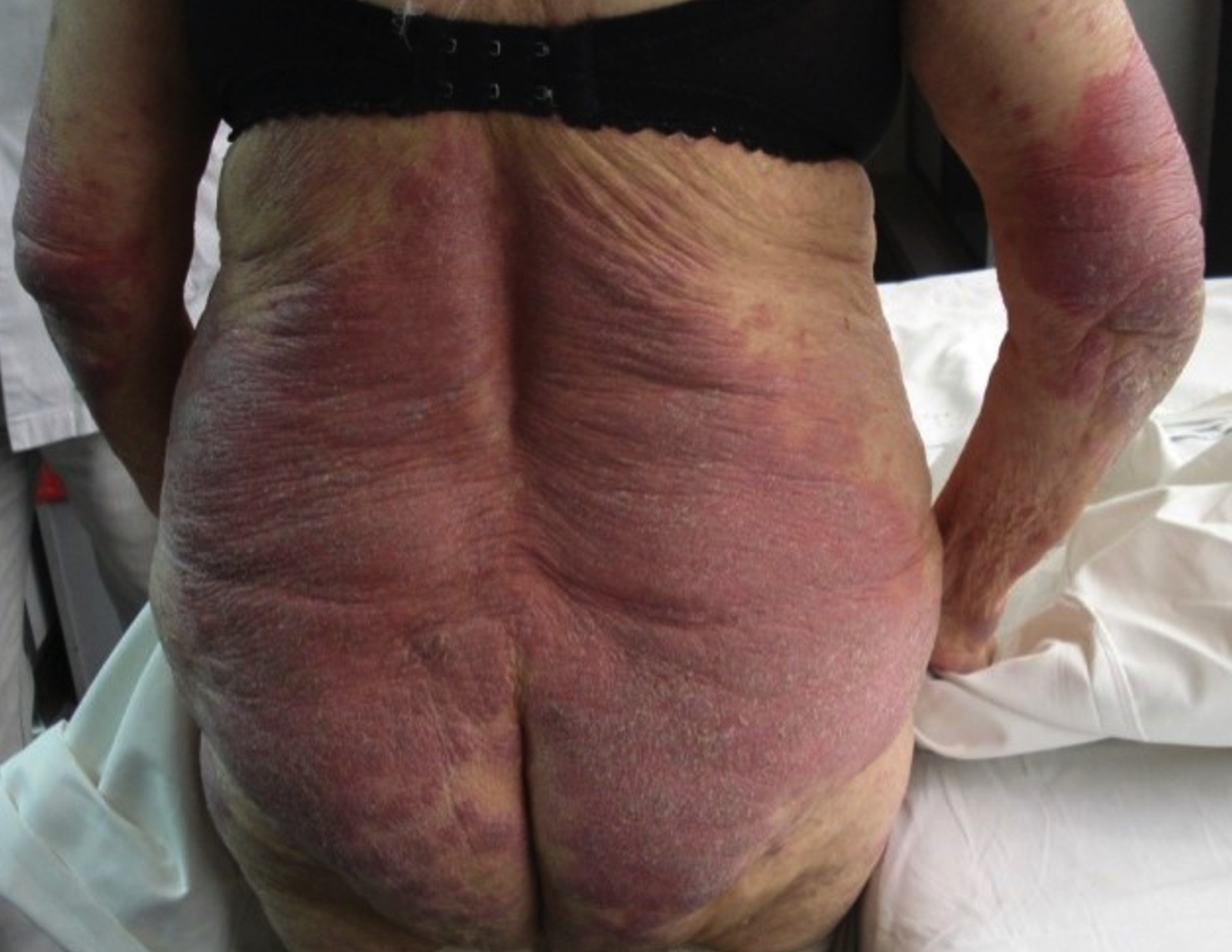
Foto 6. Micosis fungoide clásica. Estadio de placa
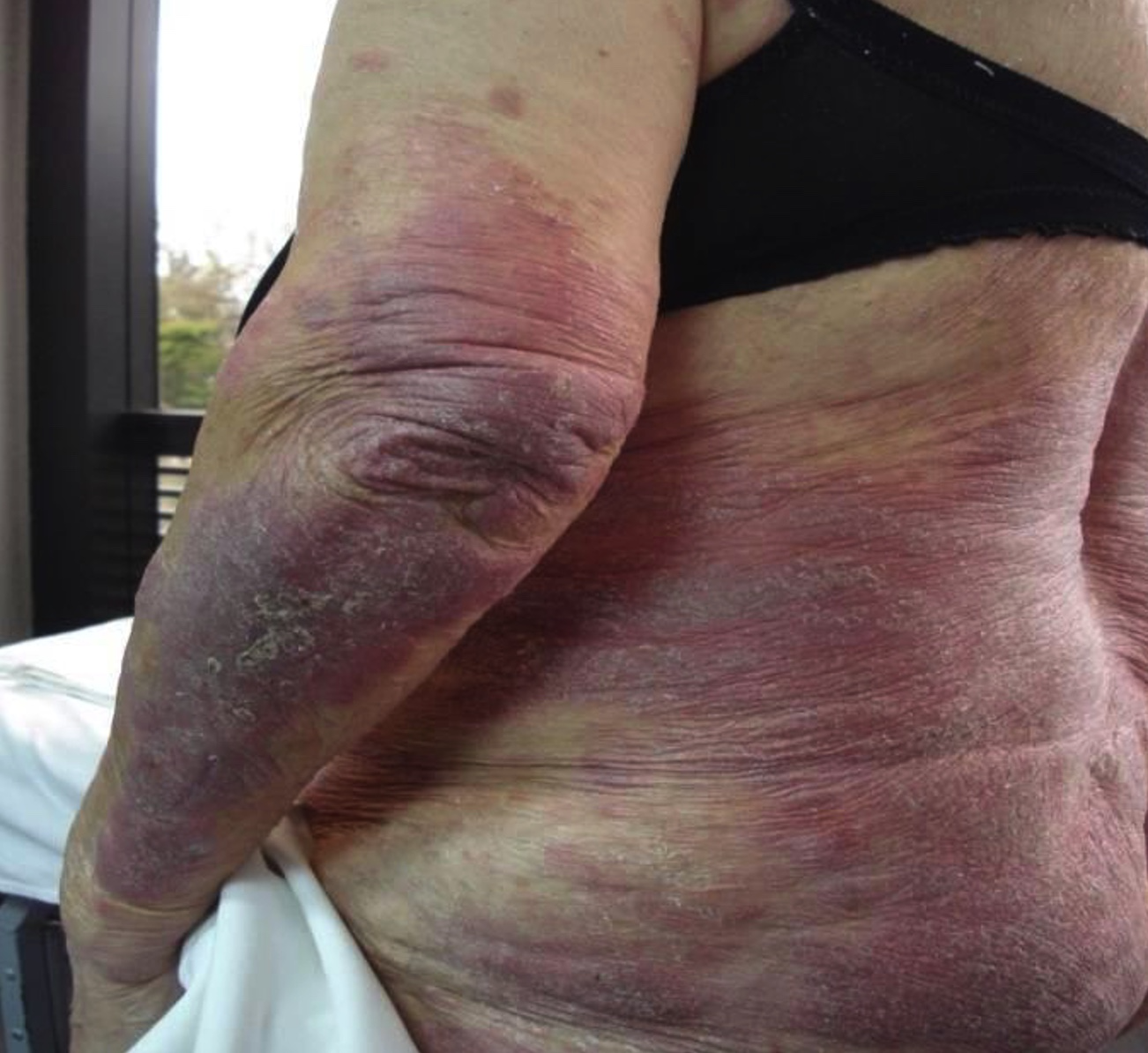
Foto 7. Micosis fungoide clásica. Estadio de placa
 Foto 8. Micosis fungoide. Estadio tumor
Foto 8. Micosis fungoide. Estadio tumor
Variantes de la micosis fungoide
La clasificación de la WHO-EORTC reconoce tres subtipos o variantes como entidades definidas por su clínica e histopatología:
- MF foliculotropa
- Reticulosis pagetoide
- Cutis laxa granulomatosa
MF foliculotropa
Se caracteriza por la presencia de un infiltrado linfoide con foliculotropismo, habitualmente sin componente epidérmico y con presencia de mucina. Compromete, preferentemente, áreas ricas en unidades pilosebáceas, como cabeza, cuello y tronco superior.
Afecta a adultos y, en ocasiones, a niños y adolescentes, en una proporción varón-mujer de 4: 1.
Clínicamente, puede presentarse con pápulas foliculares agrupadas, placas induradas, lesiones acneiformes, símil comedones o quistes epidérmicos, queratosis folicular y alopecia. Puede coexistir con lesiones de MF clásica. El prurito suele ser severo.
El inmunofenotipo es similar a la MF clásica: CD3+, CD4+, CD8-.
Reticulosis pagetoide
Se caracteriza por una mácula o placa psoriasiforme localizada generalmente en extremidades, que expresa una proliferación intraepidérmica de células T neoplásicas. Conocida también como «enfermedad de Wöringer-Kolopp», es de rara presentación y buen pronóstico.
El inmunofenotipo puede ser 1) fenotipo T helper CD4+ (CD3+, CD4+, CD8-); 2) fenotipo T citotóxico CD8+ (CD3+, CD4-, CD8+); 3) fenotipo doble negativo (CD3+, CD4-, CD8-).
Cutis laxa granulomatosa
Se caracteriza por el desarrollo de piel laxa y péndula localizada en pliegues. Estas lesiones comienzan con pequeñas máculas y placas eritematovioláceas de superficie levemente atrófica y descamación fina, habitualmente asintomáticas.
Se define histológicamente por la formación de granulomas con linfocitos atípicos, macrófagos y células gigantes asociadas a elastólisis.
Es muy poco frecuente, suele afectar a varones adultos, y es una variante poco agresiva y de curso prolongado (años).
El inmunofenotipo más frecuente es CD3+, CD4+, CD8-.
Síndrome de Sézary
El síndrome de Sézary (SS) es la variante leucémica del LCCT, caracterizada por eritrodermia, linfadenopatías generalizadas y células T neoplásicas (células de Sézary) en sangre periférica. Está asociada a un mal pronóstico. La célula de Sézary es un linfocito atípico de núcleo cerebriforme, que a la microscopía electrónica presenta un núcleo convoluto con indentaciones estrechas y profundas.
Para que un LCCT sea considerado síndrome de Sézary, debe tener presencia de población linfocitaria T monoclonal en sangre periférica y cualquiera de las siguientes características: recuento absoluto de células de Sézary de 1000/mm³ o más, o bien uno de estos criterios: 1) índice de CD4/CD8 igual o mayor que 10 por citometría de flujo de sangre periférica; 2) CD4+ CD7- ≥40 % del total de linfocitos por citometría de flujo de sangre periférica; 3) CD4+ CD26- ≥30 % del total de linfocitos por citometría de flujo de sangre periférica
Los pacientes se presentan eritrodérmicos, con descamación e islotes de piel sana; muchos tienen historia de dermatitis crónica, linfadenopatías generalizadas, fiebre, malestar general, prurito intenso, mala homeostasis de la temperatura corporal, fascies leonina, queratodermia, alopecia, ectropión, distrofia ungueal (fotos 9 y 10).
El cuadro histopatológico más frecuente es indistinguible del de la MF; en ocasiones, puede ser inespecífico.
El inmunofenotipo habitual es CD2+, CD3+, CD4+, CD8- con marcado incremento de la población CD4, lo que da en sangre periférica una relación CD4/CD8 >10. Suele tener ausencia de expresión de CD7 en las células T malignas.
Un criterio diagnóstico importante es la demostración de clonalidad de la célula T (TCR α/β+) en piel y sangre periférica.
El pronóstico del SS suele ser malo, con una sobrevida de entre 2 y 4 años.
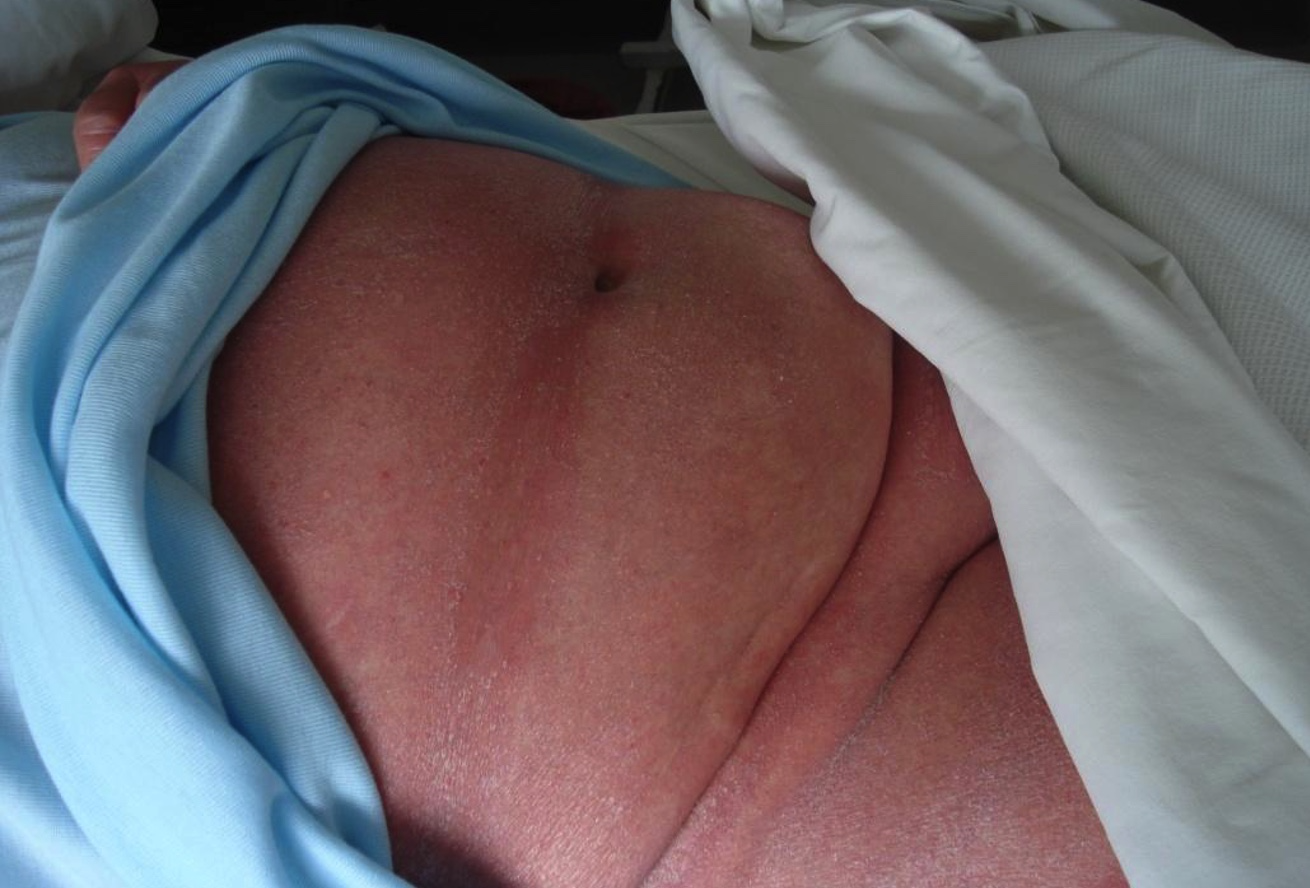
Foto 9. Sézary
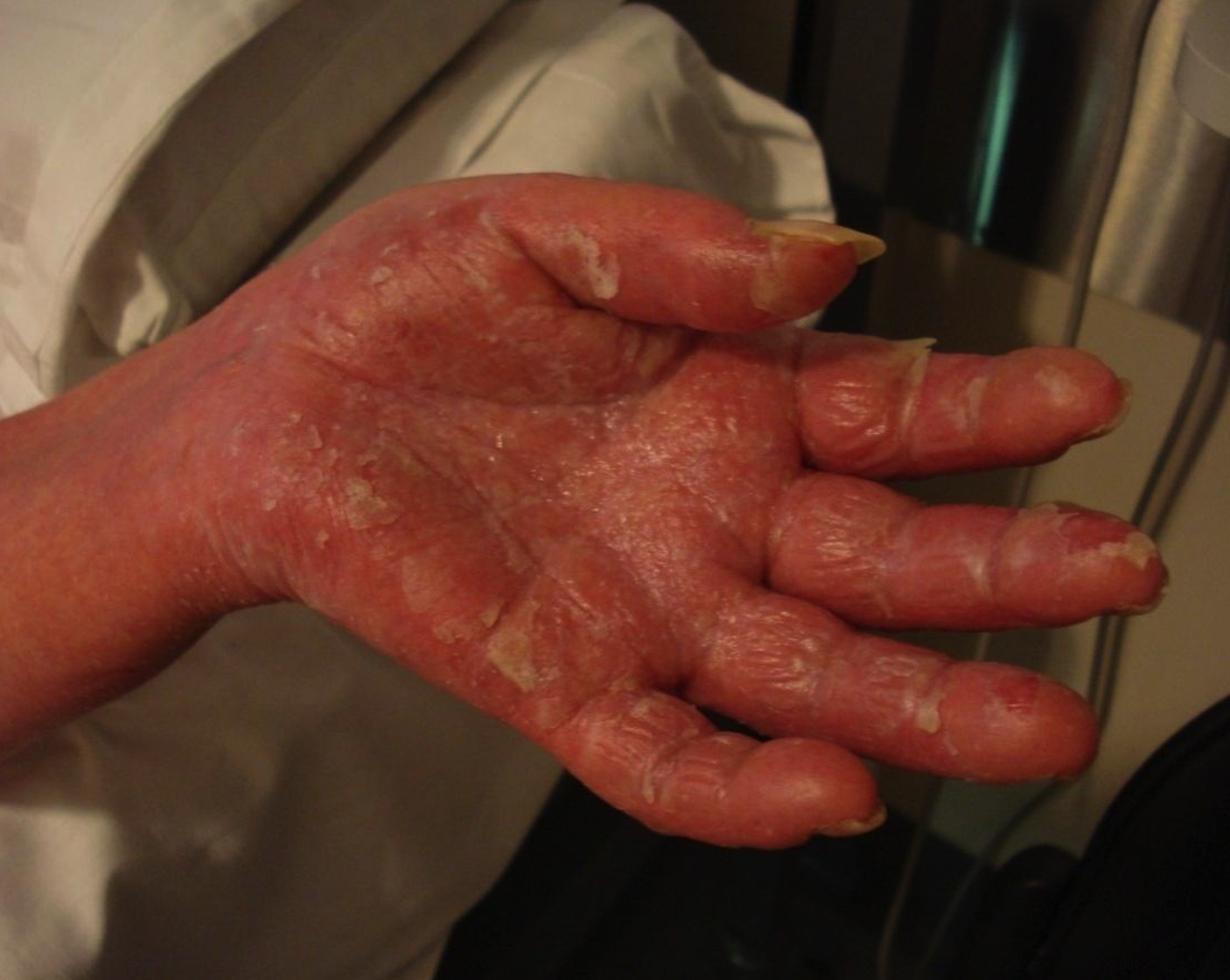 Foto 10. Sézary
Foto 10. Sézary
Estadificación de la micosis fungoide y el síndrome de Sézary
En enfermedades oncológicas, la estadificación del paciente es el indicador terapéutico y pronóstico primario. En la MF y el SS, se utiliza la clasificación TNMB (tumor, nódulo, metástasis, compromiso de sangre) con este propósito.
| TNMB | Descripción de TNMB |
| Piel | |
| T1 | Máculas, placas limitadas en <10 % de la superficie cutánea |
| T2 | Máculas, placas en ≥10 % de la superficie cutánea |
| T3 | 1 o más tumores ≥1 cm de diámetro |
| T4 | Eritrodermia |
| Nódulo linfático | |
| N0 | Sin anormalidad clínica de ganglio periférico o central: no se requiere biopsia |
| N1 | Linfadenopatía dermatopática |
| N2 | Infiltrado de células neoplásicas. Arquitectura conservada |
| N3 | Infiltrado de células neoplásicas con pérdida parcial o total de la arquitectura del ganglio |
| N X | Anormalidad clínica de ganglios periférico o central, sin confirmación histológica |
| Órganos | |
| M0 | Sin órganos comprometidos |
| M1 | Compromiso de órganos, con confirmación histológica |
| Sangre | |
| B0 | Ausencia de compromiso significativo: ≤5 % de células de Sézary |
| B1 | Baja carga tumoral en sangre: >5 % de células de Sézary, pero no cumple criterios para B2 |
| B2 | Alta carga tumoral: ≥ 1000/μL células de Sézary |
Estadios MF/SS
| Estadio | T | N | M | B |
| IA | 1 | 0 | 0 | 0,1 |
| IB | 2 | 0 | 0 | 0, 1 |
| IIA | 1-2 | 1,2 | 0 | 0,1 |
| IIB | 3 | 0-2 | 0 | 0,1 |
| IIIA | 4 | 0-2 | 0 | 0 |
| IIIB | 4 | 0-2 | 0 | 1 |
| IVA1 | 1-4 | 0-2 | 0 | 2 |
| IVA2 | 1-4 | 3 | 0 | 0-2 |
| IVB | 1-4 | 0-3 | 1 | 0-2 |
Tratamiento de la micosis fungoide
Depende del estadio de la enfermedad. En estadios tempranos, se utilizan los corticoides tópicos clase 3-4, la fototerapia (UVB de banda angosta o PUVA), bexaroteno tópico (retinoide), carmustina (BCNU) y mecloretamina tópicas, radioterapia (rayos X o lluvia de electrones). En estadios más avanzados, se agregan tratamientos sistémicos, como interferón (IFN), retinoides, quimioterapia (mono o poliquimioterapia), anticuerpos monoclonales, fotoféresis extracorpórea.
Tratamiento del síndrome de Sézary
Debe ser realizado por parte de un equipo multidisciplinario (dermatólogos, hematooncólogos y radioterapeutas). La fotoféresis extracorpórea (ECP) se considera el tratamiento de primera línea en el síndrome de Sézary. La radioterapia TSEB (lluvia de electrones de cuerpo entero) reduce la carga tumoral cutánea y es una buena combinación con la ECP para el mantenimiento. Los retinoides, el IFN y la ECP se utilizan combinados. La quimioterapia sistémica, ya sea monoquimioterapia con metotrexato, doxorrubicina, gemcitabina, etopósido, ciclofosfamida y fludarabina o poliquimioterapia, también está indicada. El trasplante de células hematopoyéticas es una alternativa terapéutica.
Desórdenes linfoproliferativos CD30+ cutáneos primarios
Estas entidades incluyen la papulosis linfomatoide (LyP), el linfoma de células grandes anaplásico CD30 + primario cutáneo y los casos borderline. Estos desórdenes son la segunda causa en frecuencia de LCCT, ya que constituyen alrededor del 30 % de los casos. Se acepta hoy que son los extremos de un espectro de enfermedades que muestran características histológicas e inmunofenotípicas similares, pero difieren en la clínica y la evolución.
El pronóstico de estos procesos es excelente. Evolucionan por brotes y remisiones. Pueden tener antecedentes de otros linfomas, en especial linfoma de Hodgkin, linfoma de células grandes anaplásicas ganglionar y MF.
Papulosis linfomatoide
Se manifiesta en pacientes entre la cuarta y quinta década de la vida como pápulas agrupadas o diseminadas, con predominio en tronco y miembros (con menos frecuencia, en cara, palmas, plantas, cuero cabelludo y genitales), que pueden ser papulonodulares, necróticas (foto 11). Se presentan en diferentes estadios de evolución, regresan de manera espontánea en pocos meses y pueden dejar cicatrices e hipo o hiperpigmentación. Las lesiones pueden ser pocas o hasta más de 100. Puede tardar unas semanas, unos años e incluso décadas en curarse. Hasta en el 20 a 25 % de los pacientes puede estar precedida, asociada o seguida por otro linfoma cutáneo.
Se distinguen seis patrones histopatológicos (foto 12). Varios de ellos pueden presentarse al mismo tiempo en un individuo: LyP tipo A, que es la presentación histológica más frecuente; LyP tipo B, que histológicamente remeda la MF; LyP tipo C; LyP tipo D; LyP tipo E, y LyP tipo F.
Es importante tener en cuenta que el curso y el pronóstico no cambian por el fenotipo de los linfocitos atípicos.
Los linfocitos atípicos en la LyP presentan un fenotipo de células T helper que expresan CD3, CD4, CD30, CD45RO, HLA-DR y CD25. El CD30 se expresa en los linfocitos atípicos de mediano a gran tamaño, en todos los tipos excepto el B.
La monoclonalidad del TCR no se detecta en todos los casos LyP.
Debido al excelente pronóstico, esperar y observar puede justificarse en el manejo de la LyP, ya que las intervenciones terapéuticas no han probado modificar el curso de la enfermedad o prevenir el desarrollo de linfomas asociados a LyP.
El tratamiento incluye la observación, corticoides tópicos, metotrexato, fototerapia, retinoides sistémicos.
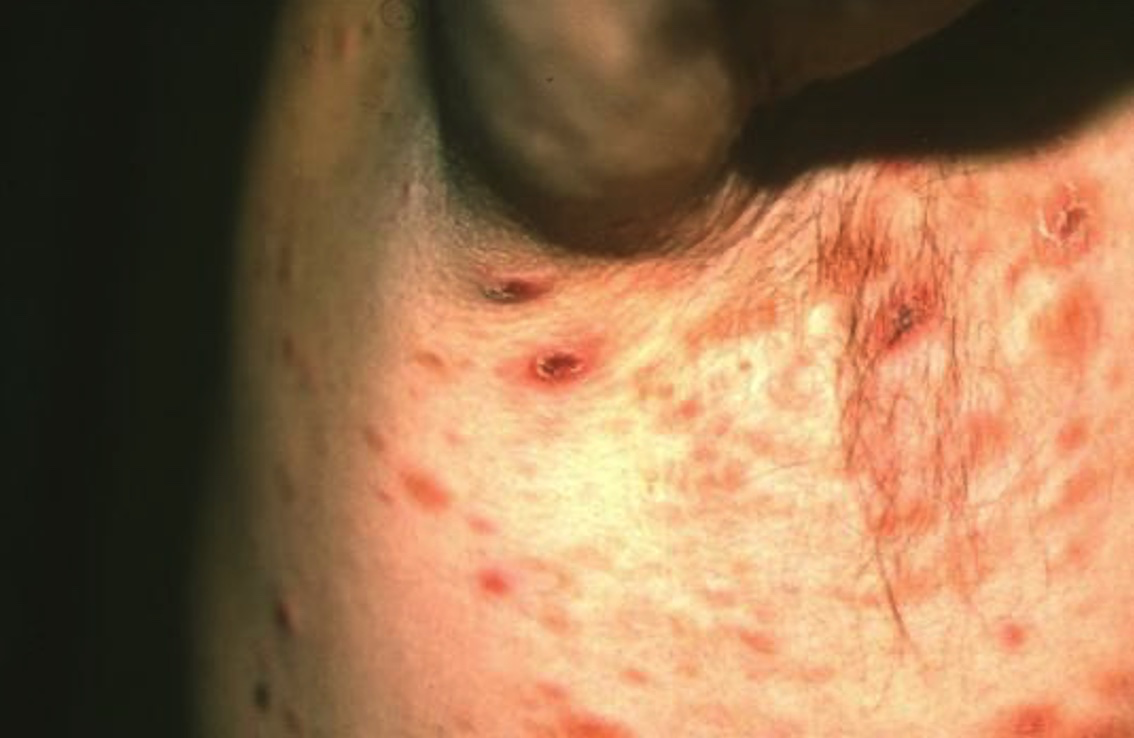
Foto 11. Papulosis linfomatoide
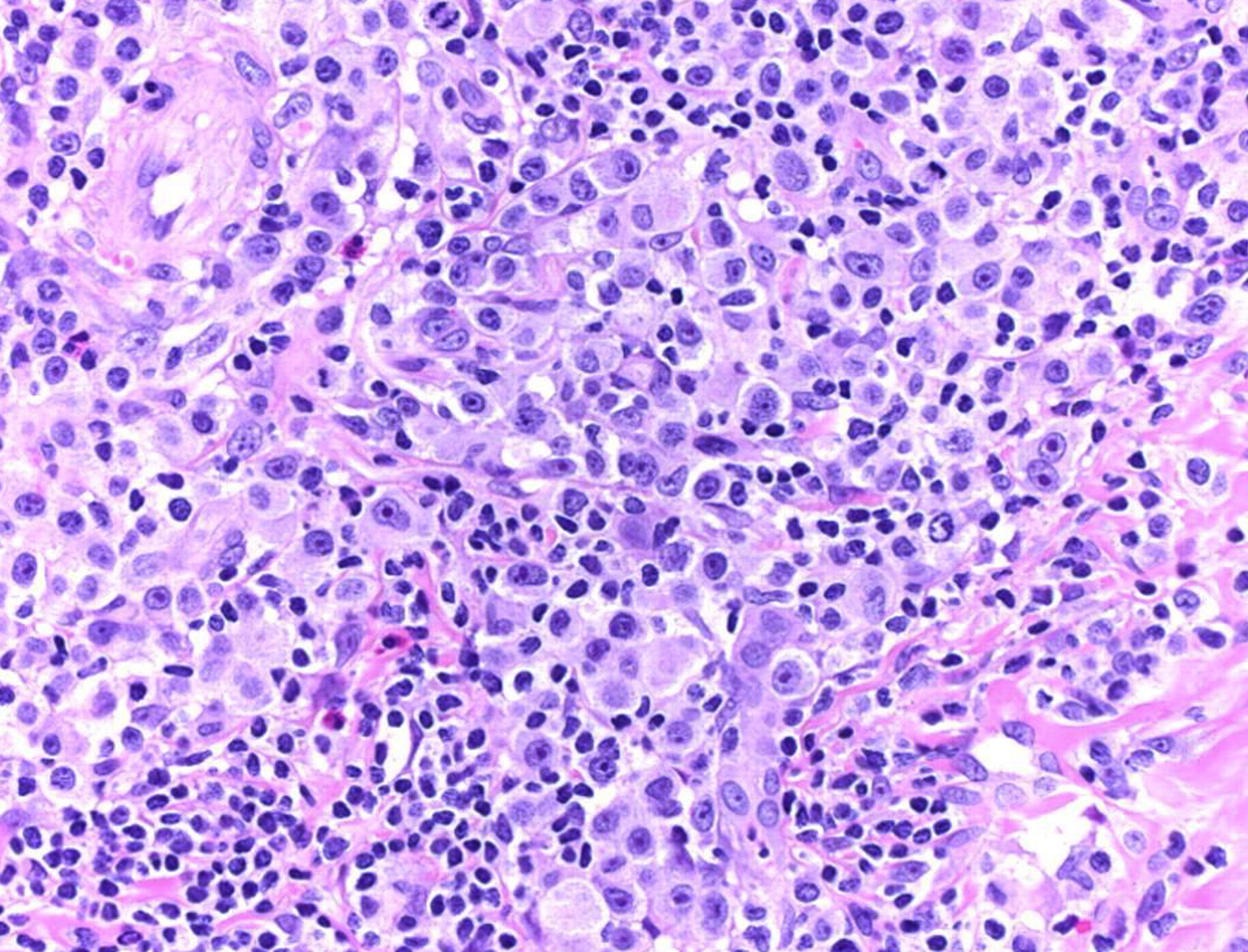
Foto 12. Histopatología. Papulosis linfomatoide
Linfoma cutáneo primario anaplásico de células grandes CD30+
Se caracteriza por células grandes anaplásicas, pleomórficas o inmunoblásticas con expresión del antígeno CD30 en más del 75 % de las células tumorales, sin evidencia clínica o historia de LyP o MF.
Afecta, principalmente, a adultos y es más frecuente en hombres, que presentan tumor o nódulo, solitario o agrupados, en la cabeza, el cuello y los miembros, aunque puede localizarse en cualquier parte del cuerpo. Suele ser autorresolutivo.
El pronóstico es, en general, favorable. Si las lesiones son solitarias, el tratamiento abarca desde la observación hasta la escisión quirúrgica o la radioterapia; si son múltiples, se tratan con metotrexato, radioterapia o retinoides.
Lesiones borderline
Cuando se utiliza el término borderline, se refiere a casos en los que, a pesar de la correlación clínico-patológica, no se puede realizar una clara diferenciación entre la LyP y el anaplásico de células grandes en el momento del diagnóstico. Es posible arribar al diagnóstico final durante el seguimiento, sobre la base del comportamiento clínico.
Es necesario recordar que la clasificación WHO-EORTC considera otras entidades, tales como el linfoma de células T subcutáneo símil paniculitis; el linfoma de células T extranodal NK/T (Natural Killer), tipo nasal; los linfomas T periféricos cutáneos primarios no especificados, y el linfoma T epidermotropo agresivo CD8+ (provisional), los cuales no serán desarrollados debido a su baja incidencia.
Linfomas primarios cutáneos de células B (LCCB)
Los LCCB son un grupo heterogéneo de linfomas extranodales del tipo no Hodgkin, caracterizados por la proliferación clonal de linfocitos B. Representan, aproximadamente, el 25 % del total de los LCP.
Se caracterizan por tumores únicos o escasos, de superficie lisa, sin tendencia a la ulceración, habitualmente en un área anatómica.
El cuadro histopatológico consiste en infiltrados bien delimitados de linfocitos, que respetan la epidermis y la dermis papilar; estas células son inmunofenotípicamente B CD19+, CD20+, CD22, CD79a.
Los LCCB son monoclonales, por lo que la mayoría de las células tiene un mismo tipo de cadena liviana, sea kappa o lambda, en general en una proporción mayor que 10:1.
Suelen ser de buen pronóstico.
Linfoma B primario cutáneo de la zona marginal
(MALT-SALT, incluye linfoplasmocitoide, plasmocítico, hiperplasia folicular linfoide con células plasmáticas monotípicas, inmunocitoma y plasmocitoma)
Linfomas derivados de la zona marginal del centro germinativo. Tienen heterogeneidad histológica de células B pequeñas: símil centrocitos, linfoplasmocitoides o células plasmáticas.
Representan alrededor del 7 % de los LCP y se los ha relacionado con frecuencia a Borrelia burgdorferi, transmitida por la picadura de pulga. Es más habitual en varones y la edad media de aparición es a los 55 años.
Se caracterizan por tumores eritematosos o eritematovioláceos, indurados, de superficie lisa, solitarios o múltiples, localizados en las extremidades, los glúteos, el tronco y, con menos frecuencia, en la cabeza. Crecen lentamente, el compromiso sistémico es raro y el pronóstico es excelente.
El cuadro histopatológico se caracteriza por un infiltrado dérmico con patrón nodular, perivascular y perianexial, o difuso, que respeta la epidermis, constituido por células linfoides pequeñas a intermedias, células linfoplasmocitoides, o monocitoides con citoplasma claro abundante y plasmocitos; pueden verse células con inclusiones intranucleares propios de la estirpe B con diferenciación plasmocítica. Se suelen observar, además de este infiltrado, células reactivas (linfocitos, histiocitos, eosinófilos, mastocitos) y estructuras foliculares con centros germinales reactivos. Estas características le otorgan un aspecto inflamatorio que plantea el diagnóstico diferencial con hiperplasias linfoides reactivas.
Las células B neoplásicas, que pueden ser muy escasas, son CD20+, CD79a+, Bcl-2+, y Bcl-6-, CD10-, CD5-. También pueden expresar CD43+, KIM1p+. Las células plasmáticas son CD20-, CD138+, MUM1⁄IRF4+. Los centros germinales reactivos son Bcl-6+, CD10+, Bcl-2-. La monoclonalidad para cadenas livianas, kappa y lambda, debe buscarse en plasmocitos o células linfoplasmocitoides y es confirmatoria para el diagnóstico.
El tratamiento de los pacientes con lesiones solitarias es radioterapia o extirpación quirúrgica; con lesiones múltiples, clorambucilo, interferón alfa o rituximab. Si se detecta Borrelia burgdorferi, se indican antibióticos.
El pronóstico es muy bueno y la sobrevida a los 5 años es del 100 %.
Linfoma B primario cutáneo centrofolicular
Es el LCCB más frecuente; corresponde al 60 % de los LCCB y al 10 % de los LCP. Se presenta alrededor de los 50 años.
Es un linfoma de células B con características citomorfológicas e inmunofenotípicas de células centrofoliculares, constituido por centrocitos (núcleo denso hendido) y centroblastos (núcleo grande no hendido y nucléolo prominente).
Se lo ha asociado con Borrelia burgdorferi como factor etiológico en algunos casos.
Clínicamente, se manifiesta con lesiones papuloides, placas o tumores eritematovioláceos, que pueden ser únicos o escasos, localizados con mayor frecuencia en cabeza y cuello.
El cuadro histopatológico se caracteriza por un infiltrado de centrocitos y centroblastos en variable proporción, con patrón de crecimiento principalmente folicular, sin epidermotropismo.
Los linfocitos neoplásicos expresan CD19+, CD20+, CD79a+, PAX5+, y Bcl-6+. Por lo general, el Bcl-2 es negativo o débil y solo en una minoría de casos puede ser positivo. El CD10- es variable y suele expresarse únicamente en el patrón de crecimiento folicular.
En etapas avanzadas, se observa restricción de cadenas de inmunoglobulinas (Igs) mediante inmunohistoquímica o, eventualmente, citometría de flujo.
El tratamiento de los pacientes con lesiones solitarias es radioterapia o extirpación quirúrgica, y con lesiones múltiples, interferón alfa o rituximab sistémico o intralesional; en casos refractarios, se indica poliquimioterapia. Si se detecta Borrelia burgdorferi, se recetan antibióticos.
El pronóstico es bueno y la sobrevida a los 5 años es del 95 %.
Linfoma B primario cutáneo difuso, de células grandes, de la pierna
Es un linfoma que se presenta con tumores o nódulos, de crecimiento rápido, que suelen localizarse en el tercio inferior de miembros inferiores. Su diseminación extracutánea es frecuente. Es más habitual en mujeres de 70 años en promedio.
El cuadro histopatológico se caracteriza por infiltrado denso difuso de células grandes redondas con alta actividad mitótica, compuesto por centroblastos e inmunoblastos, que suele respetar la epidermis, compromete la dermis y puede alcanzar el tejido celular subcutáneo.
Los linfocitos neoplásicos tienen un inmunofenotipo CD20+, CD79a+, Pax-5+ que incluye la positividad de Bcl-2 y MUM1. El Ki-67 es positivo en más del 70 % de las células.
Pueden presentar translocación de MYC y de Bcl-6.
El tratamiento consiste en R-CHOP (rituximab-ciclofosfamida, doxorrubicina, vincristina y prednisona) y radioterapia. La sobrevida a los 5 años es de, aproximadamente, el 50%.
Puntos clave
- Los linfomas cutáneos primarios (LCP) se definen como linfomas no Hodgkin que se presentan en la piel sin evidencia de enfermedad extracutánea al momento del diagnóstico.
- Representan un grupo heterogéneo de entidades con pronóstico y características epidemiológicas, clínicas, histológicas y moleculares distintas.
- Son el segundo grupo en frecuencia de los linfomas extranodales, después de los linfomas gastrointestinales primarios.
- Este grupo está compuesto por neoplasias, principalmente de linfocitos T y de linfocitos B, que tienen tropismo específico por la piel; con menos frecuencia, son proliferaciones de células Natural Killer y dendríticas plasmocitoides.
- Su incidencia anual es baja: de 0,5 a 1 por 100.000 habitantes.
- Los linfomas cutáneos de células T (LCCT) son los más frecuentes; una de sus variantes, la micosis fungoide, da cuenta de entre el 50 y 65 % de ellos, mientras que el resto de los LCCT representan un 25 %. Los linfomas cutáneos tipo B (LCCB) conforman el 25 % restante.
- En la clasificación de los LCT, se reconoce que el comportamiento clínico y el pronóstico son diferentes a los linfomas sistémicos que presentan un cuadro histológico similar. Esta diferencia es importante para definir los linfomas cutáneos primarios, debido a que la mayoría de ellos tienen un curso menos agresivo y requieren tratamientos menos complejos, dirigidos muchas veces solo a la piel.
Bibliografía recomendada
Willemze R. Cutaneous T-Cell Lymphoma. En: Bolognia JL, Schaffer JV, Cerroni L (eds.). Dermatology. 4ª edición. Filadelfia: Elsevier Limited; 2018. pp. 2127-2147.
Cerroni L. B-Cell Lymphomas of the Skin. En: Bolognia JL, Schaffer JV, Cerroni L (eds.). Dermatology. 4ª edición. Filadelfia: Elsevier Limited; 2018. pp. 2113-2126.
Beyer M y Sterry W. Cutaneous lymphoma. En: Fitzpatrick’s Dermatology in General Medicine. 8ª edición. Nueva York: McGraw-Hill; 2012. pp. 1745-1765.
Consenso Linfomas Primarios Cutáneos. Actualización 2018. Sociedad Argentina de Dermatología.
Jawed SI, Myskowski PL, Horwitz S, et al. Primary cutaneous T-cell lymphoma (mycosis fungoides and Sézary syndrome): part I. Diagnosis: clinical and histopathologic features and new molecular and biologic markers. J Am Acad Dermatol. 2014;70:205.e1-16.
Jawed S, Myskowski P, Horwitz S, et al. Primary cutaneous T-cell lymphoma (Micosis fungoides and Sezary syndrome): part II. Prognosis, management, and future directions. J Am Acad Dermatol. 2014;70:223.e1-17.
Willemze R, Jaffe ES, Burg G, et al. WHO-EORTC classification for cutaneous lymphomas. Blood. 2005;105:3768-3785.
Olsen EA. Evaluation, diagnosis, and staging of cutaneous lymphoma. Dermatol Clin. 2015;643-654.
Strutton G. Cutaneous infiltrate lymphomatous and leukemic. En: Weedon’s Skin Pathology. 3ª edición. Londres: Churchill Livingstone Elsevier; 2010.


