El melanoma es el cáncer que se desarrolla a partir de los melanocitos, células que surgen de la cresta neural y migran a la epidermis, la úvea, las meninges y la mucosa ectodérmica. El melanoma tiene alta capacidad metastatizante.
Epidemiología
El melanoma representa alrededor del 1 % de los cánceres cutáneos. La incidencia del melanoma cutáneo ha aumentado rápidamente en las últimas décadas. En los Estados Unidos, la incidencia anual entre 2011 y 2015 fue de 21,2 cada 100.000 habitantes, mientras que la tasa de mortalidad entre 2012 y 2016 fue de 2,5 cada 100.000 habitantes.
El melanoma es veinte veces más frecuente en la raza blanca que en la raza negra. El riesgo de tener un melanoma en una persona de raza blanca es de 2,3 %, mientras que en hispánicos es del 0,6 % y en la raza negra del 0,1 %. En general, es más frecuente en hombres, pero debajo de los 50 años las tasas son más altas en las mujeres. El riesgo aumenta con la edad. Sin embargo, no es infrecuente en personas jóvenes; incluso es uno de los cánceres más frecuentes en adultos jóvenes. En la Argentina, la mayor incidencia se da en individuos mayores de 50 años.
Etiopatogenia
Múltiples factores intervienen en la patogenia; el más importante es el genético. Se producen mutaciones en genes que generan activación de vías de crecimiento y diferenciación celular, mutaciones en genes supresores de tumores, además de cambios epigenéticos. Muchos genes están implicados en el desarrollo del melanoma, incluidos el CDKN2A (p16-p14), CDK4, BAP-1, RB1, PTEN y RAS. Es especialmente importante el CDKN2A en casos de melanomas esporádicos y hereditarios.
A pesar de que los nevos melanocíticos benignos presentan mutaciones drivers o conductoras, el melanoma se desarrolla por una acumulación y progresión de mutaciones, algunas relacionadas con la exposición a la radiación ultravioleta (RUV). Dentro del espectro de la RUV, la radiación UVA es la principal promotora del daño en el ADN, ya que penetra profundamente en la dermis. La mayor parte de los melanomas cutáneos presenta mutaciones asociadas a la RUV, mientras que otros subtipos, como los melanomas acrales y mucosos, presentan aberraciones en las variantes estructurales e incluso no codificantes de los genes.
Factores de riesgo
Alto riesgo de melanoma:
- Antecedente de melanoma en un familiar de primer grado
- Síndrome del nevo atípico: 50 a 100 nevos, nevos clínicamente atípicos, nevos con displasia resecados
- Nevo melanocítico congénito gigante
- Más de 250 sesiones de fototerapia PUVA o el uso de camas solares (riesgo proporcional al número de sesiones realizadas)
- Antecedente personal de exposición solar intensa e intermitente (hábito de tomar sol, realizar deportes acuáticos, vacaciones en lugares soleados; quemaduras solares en la infancia)
- Antecedente de cáncer de piel no melanoma
- Fototipo I y II de la escala de Fitzpatrick (tabla 1), efélides, pelo rubio o rojizo
- Terapia inmunosupresora por trasplante de órgano sólido
- Algunas genodermatosis: xeroderma pigmentoso, síndrome de Cowden, síndrome de Li Fraumeni
Tabla 1. Fototipos de Fitzpatrick
| Fototipo | Respuesta frente a la exposición solar |
| I | Siempre se quema, nunca se broncea |
| II | Suele quemarse, se broncea mínimamente |
| III | Se quema moderadamente, se broncea moderada y uniformemente |
| IV | Se quema mínimamente, se broncea con intensidad |
| V | Raramente se quema, se broncea con facilidad e intensidad |
| VI | Nunca se quema, siempre se broncea |
Muy alto riesgo de melanoma:
- Más de 100 nevos
- Al menos 5 nevos melanocíticos clínicamente atípicos o displásicos
- Antecedente personal de melanoma
- Historia de más de un melanoma en la familia: dos o más familiares de primero o segundo grado con melanoma en la misma rama familiar
- Cualquier paciente con melanoma que tenga antecedentes familiares (de primero o segundo grado) de melanoma primario y carcinoma de páncreas
- Portación personal o familiar de mutaciones en los genes de susceptibilidad al melanoma: CDKN2A, CDK4, BAP1, MITF, POT1, TERT, MCR1
Debe tenerse en cuenta que existe el melanoma hereditario. Se estima que alrededor de un 5 a 12 % de los melanomas son causados por mutaciones germinales hereditarias de alta penetrancia. Los genes involucrados en el melanoma hereditario son CDKN2A (que corresponde al 40 %), CDK4, POT-1, TERT. Los pacientes con el síndrome de melanoma familiar asociado al CDKN2A presentan un riesgo de 10 a 17 % mayor de padecer cáncer de páncreas, comparado con la población general.
Clasificación
Subtipos clínico-histológicos del melanoma cutáneo
Se distinguen cuatro variedades principales de melanoma.
Melanoma extensivo superficial
Es el más frecuente (60 %). Se desarrolla, principalmente, en la edad media de la vida; la localización preferencial es el dorso en los hombres y las piernas en las mujeres. Comienza como una lesión tumoral plana o ligeramente sobreelevada, de bordes irregulares, que combina diferentes colores (negro, pardo, rojizo, blanco). Tiene relación con la exposición solar. Puede aparecer sobre piel sana (de novo) o sobre una lesión melanocítica preexistente (fotos 1 a 3).
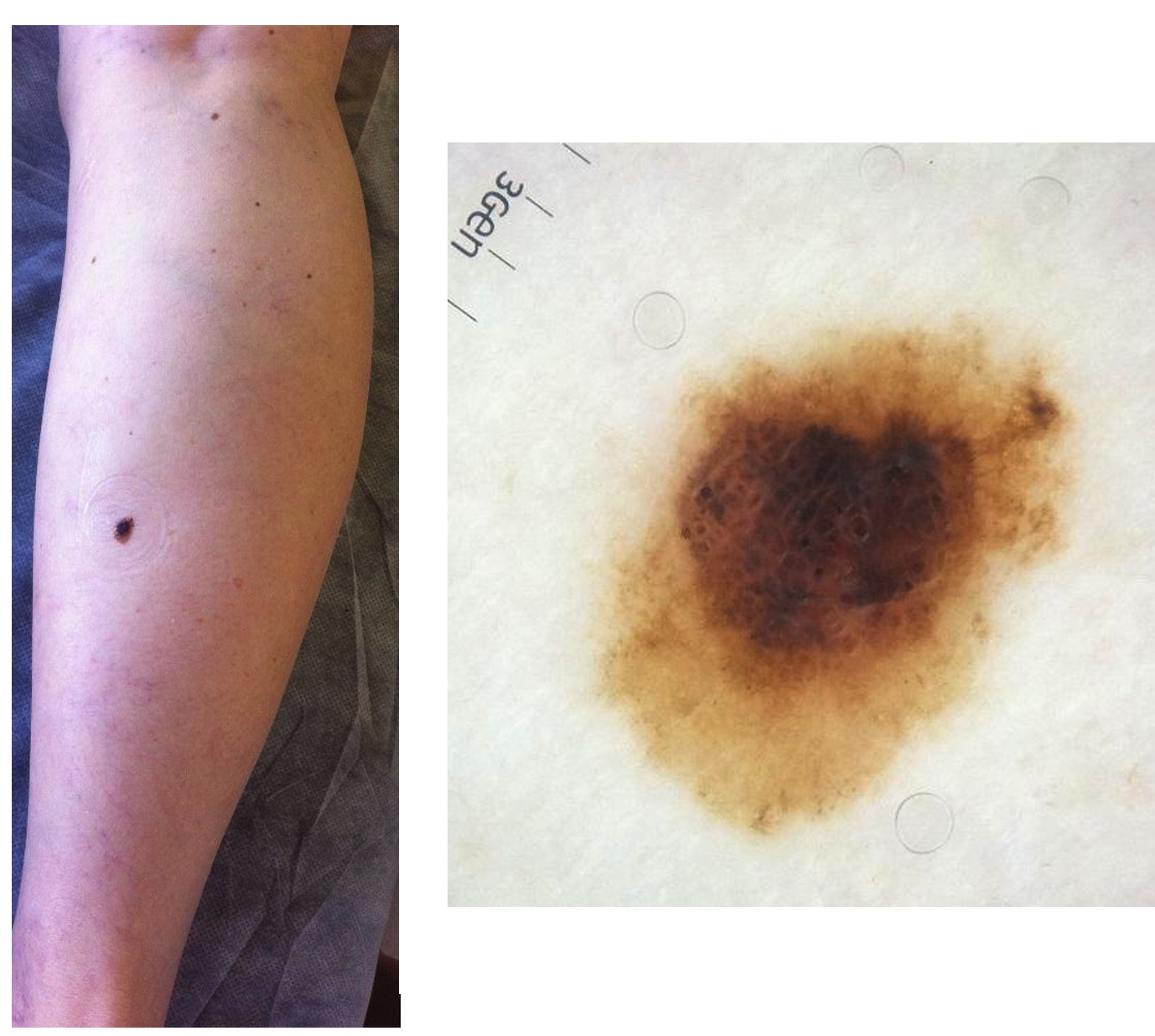
Fotos 1 y 2. Melanoma extensivo superficial (miembro inferior, mismo paciente)
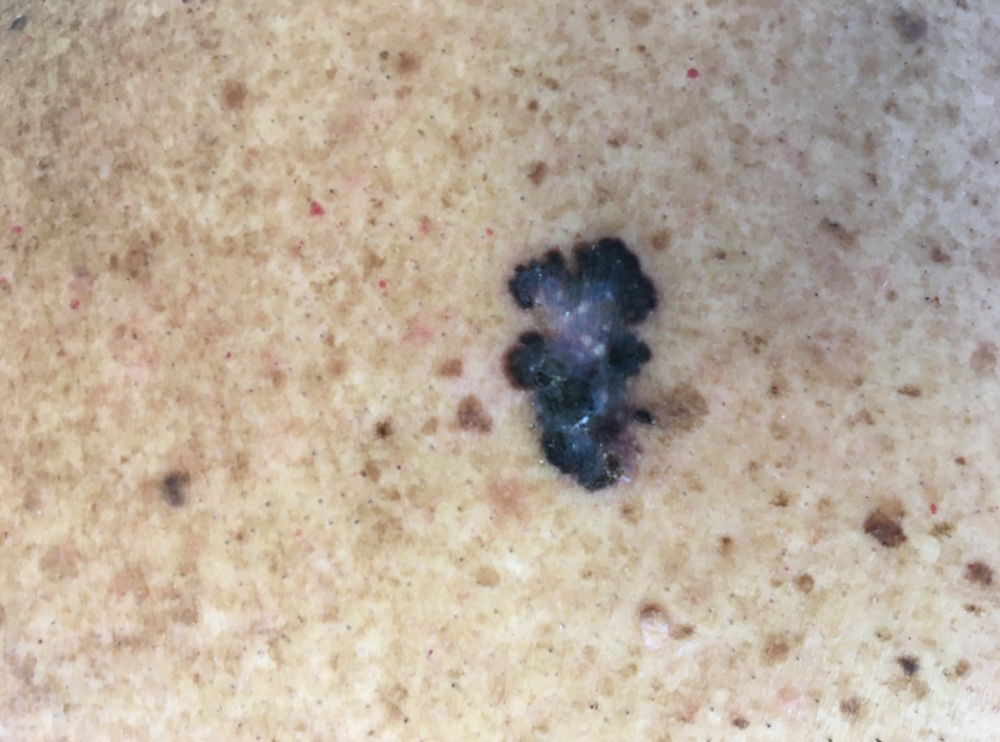
Foto 3. Melanoma extensivo superficial (dorso)
Melanoma nodular
Corresponde aproximadamente al 20 % de los melanomas. También predomina en la vida adulta. Las localizaciones más frecuentes son la cabeza, el cuello y el tronco. Posee un crecimiento dérmico o invasivo vertical desde el inicio y, en general, de evolución rápida. Se manifiesta como un tumor sólido de aspecto papuloide que con frecuencia se ulcera y sangra; puede ser pigmentado o amelanótico. El espesor de Breslow suele ser mayor que los restantes tipos de melanoma en el momento del diagnóstico (fotos 4 y 5).
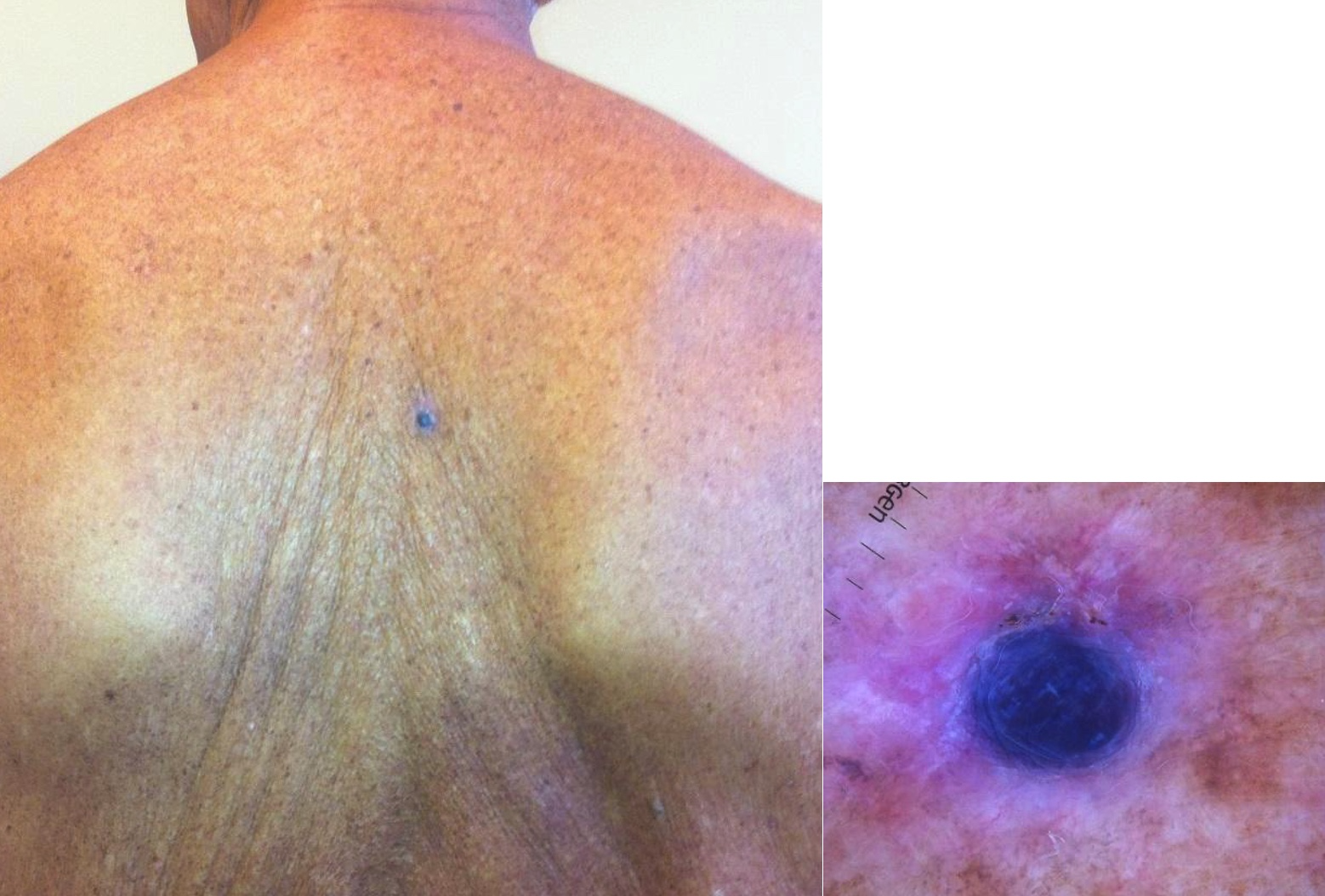
Fotos 4 y 5. Melanoma nodular (mismo paciente)
Melanoma acrolentiginoso
Corresponde al 5 % de los melanomas en la raza blanca, pero es más prevalente en las razas amarilla y negra. Se localiza en palmas, plantas y en el aparato ungueal, como una lesión tumoral plana que suele ser de color rojizo o negro. En su evolución, puede convertirse en una lesión tumoral exofítica ulcerada (fotos 6 a 8).
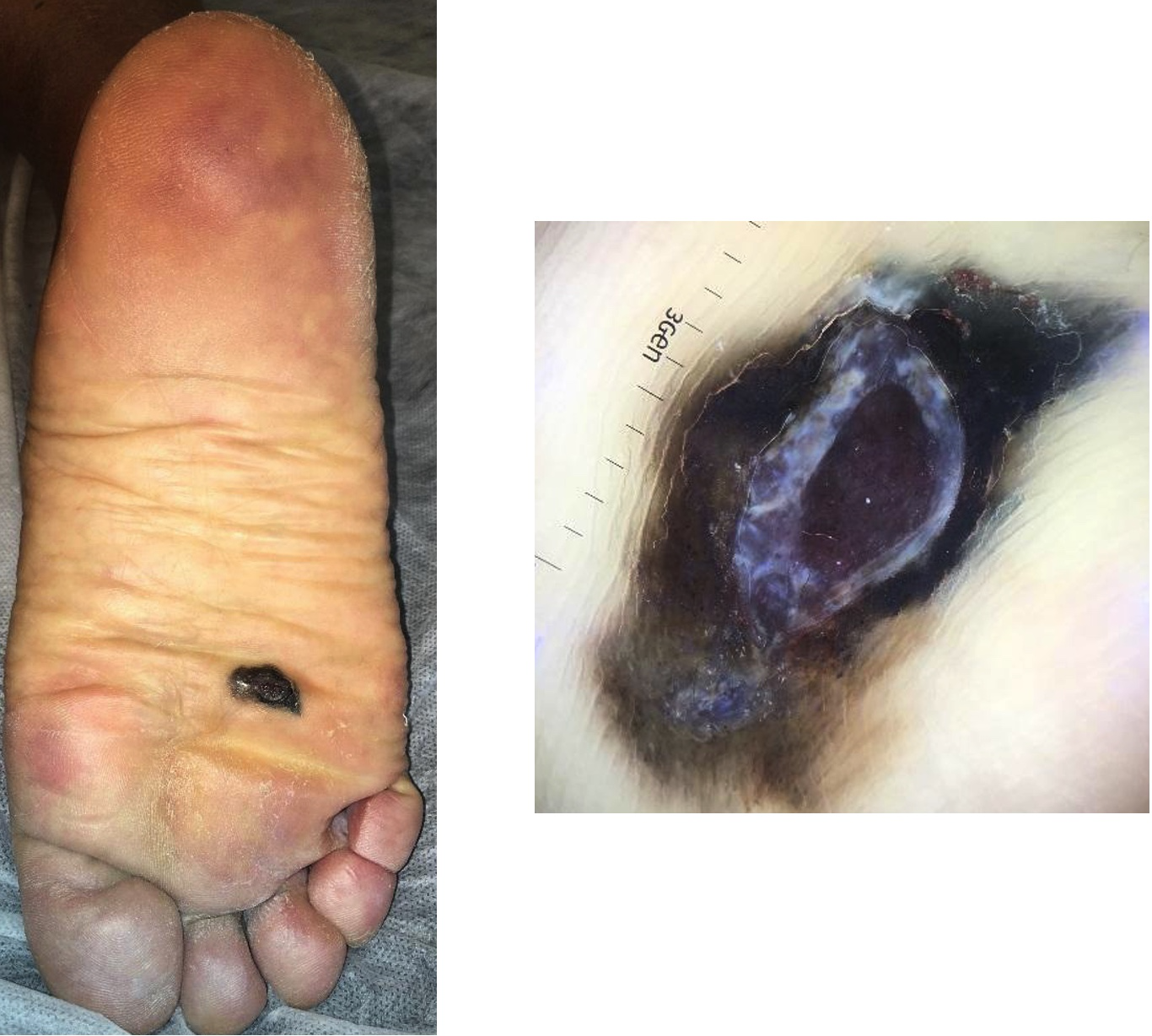
Fotos 6 y 7. Melanoma acrolentiginoso plantar (mismo paciente)
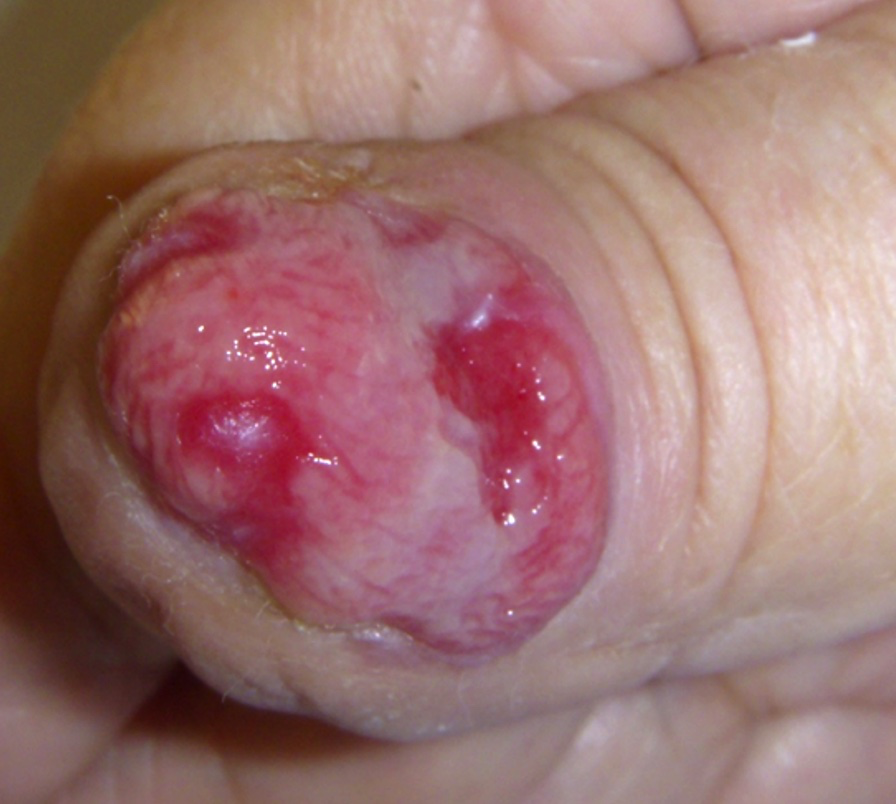
Foto 8. Melanoma acrolentiginoso del aparato ungueal
Melanoma lentigo maligno
Corresponde al 5 % de los melanomas. Predomina en pacientes añosos con historia de exposición solar intensa; por ello, la localización más frecuente es la cara. Es un tumor plano que combina colores (gris, pardo, negro), de contorno policíclico. Su evolución es lenta (fotos 9 a 11).
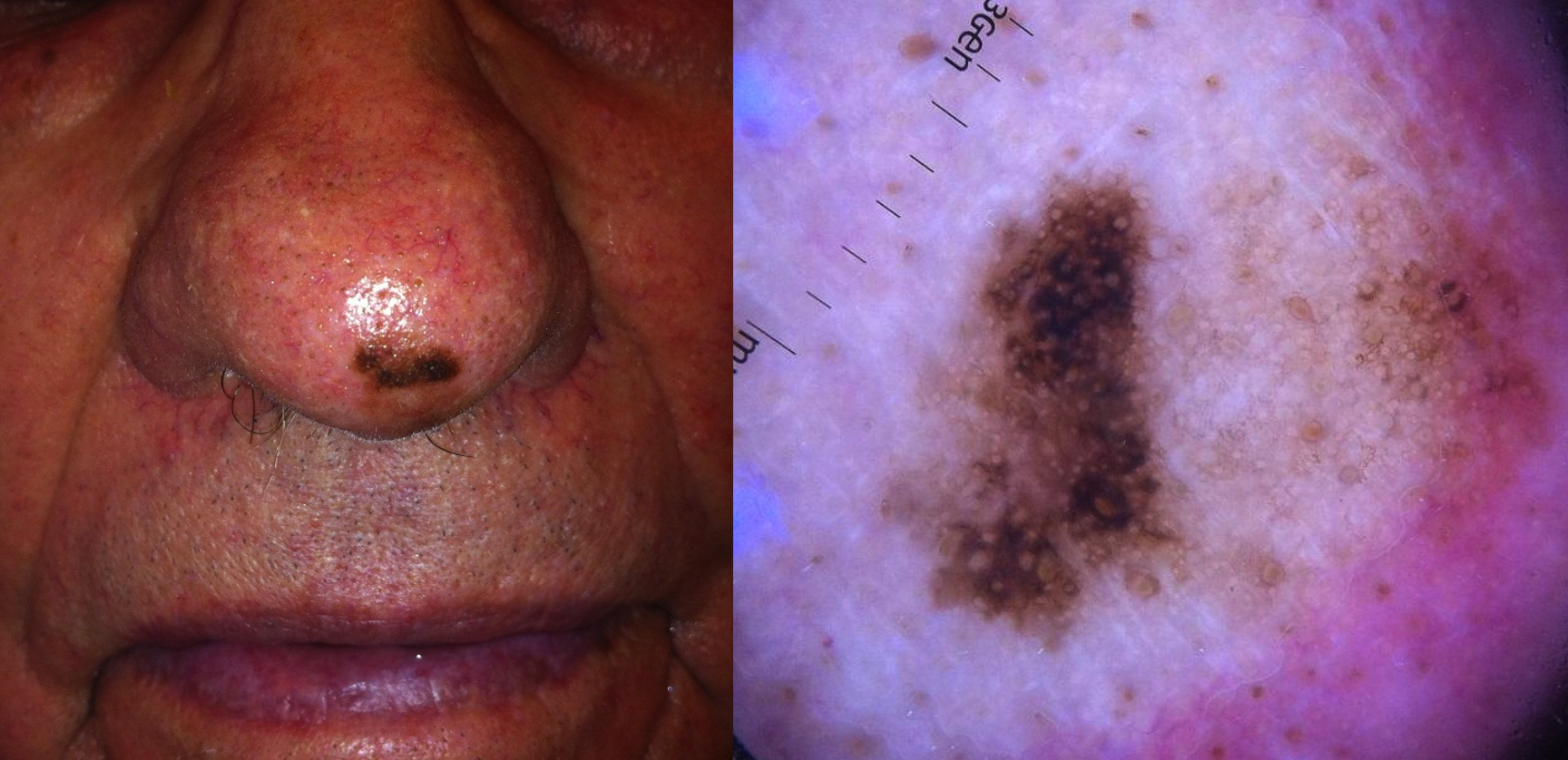 Fotos 9 y 10. Melanoma lentigo maligno (mismo paciente)
Fotos 9 y 10. Melanoma lentigo maligno (mismo paciente)
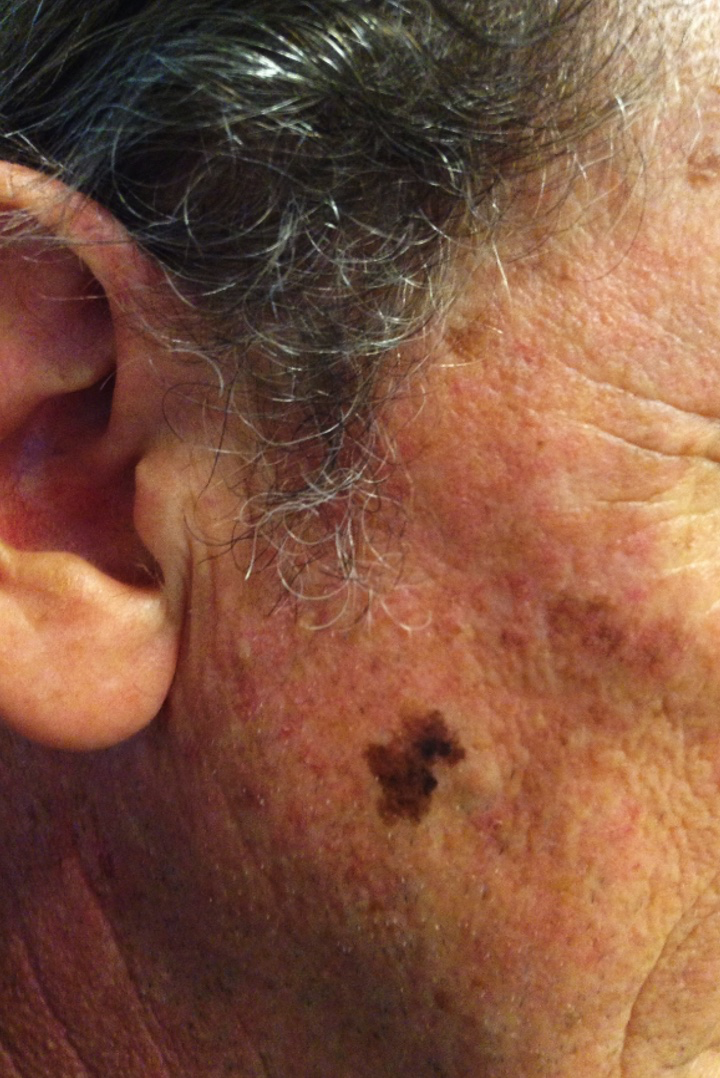
Foto 11. Melanoma lentigo maligno
Otros tipos de melanoma menos frecuentes son el melanoma de desviación mínima (o melanoma de inicio), el melanoma polipoideo, el melanoma verrugoso, el melanoma desmoplásico, el melanocitoma epitelioide pigmentado y el melanoma «tipo animal».
Clasificación de la Organización Mundial de la Salud
La cuarta edición de la Clasificación de Tumores Cutáneos de la Organización Mundial de la Salud (OMS) clasifica al melanoma en función del grado de exposición a la RUV que el paciente ha tenido en el transcurso de su vida.
- Exposición baja o nula (o variable/incidental): tumor de Spitz maligno, melanoma acral, melanoma lentiginoso de las mucosas, melanoma en nevo congénito, melanoma en nevo azul, melanoma uveal
- Exposición baja: melanoma extensivo superficial en fase de crecimiento vertical (FCV), melanoma en BIN (BAP-1 inactivated melanocytoma), melanoma en DPN (deep penetrating melanocytoma), melanoma en PEM (pigmented epitheloid melanocytoma)
- Exposición elevada: melanoma lentigo maligno y melanoma desmoplásico
Clasificación molecular
Más recientemente, se ha clasificado al melanoma en función de sus mutaciones drivers en subtipos genómicos: BRAF mutado, NRAS mutado, pérdida de función NF1 y triple tipo salvaje (triple wild-type TWT). En la tabla 2, se destacan las principales características.
Tabla 2
| Mutación | Porcentaje de melanomas con esta mutación | Asociación fenotípica |
| BRAF (V600E-V600K) | 45 a 50 % | Sitios de exposición solar intermitente
Personas jóvenes Melanoma extensivo superficial Frecuente localización en tronco Alto recuento de nevos Escasas efélides Broncea fácilmente |
| RAS (NRAS, KRAS, HRAS) | 15 a 20 % |
Asociación con daño solar crónico Personas mayores Melanoma nodular |
| Pérdida de función NF1 | 10 a 15 % | Personas mayores
Melanoma desmoplásico |
| TWT | 5 a 10 % | Melanomas uveales
Melanoma acral Melanoma mucoso |
| C-KIT | 2 % | Melanoma uveal
Melanoma acral Melanoma mucoso |
| GNAQ | 50 % MM uveales | Melanoma uveal |
Clínica
Sospecha diagnóstica
Se debe realizar un examen físico que abarque la totalidad de la piel, el cuero cabelludo y las mucosas.
La primera sospecha de un melanoma es la clínica. Es útil emplear el acrónimo ABCDE como regla nemotécnica para la detección clínica de melanomas (tabla 3).
Al observar una lesión, hay que recordar lo siguiente:
La A de asimetría en los dos ejes de la lesión
La B de bordes irregulares
La C de variedad de colores
La D de diámetro mayor de 6 mm
La E de evolución en cuanto a crecimiento, coloración u otros cambios que refiera el paciente o un familiar

La sensibilidad de este acrónimo para detectar melanomas es del 57 al 90 %, mientras que su especificidad es del 59 al 90 %. Es un método útil de sospecha para los médicos no especialistas.
Tabla 3. Estadificación clínica
| T | N | M | Estadio |
| Tis | N0 | M0 | 0 |
| T1a | N0 | M0 | IA |
| T1b | N0 | M0 | IB |
| T2a | N0 | M0 | |
| T2b | N0 | M0 | IIA |
| T3a | N0 | M0 | |
| T3b | N0 | M0 | IIB |
| T4a | N0 | M0 | |
| T4b | N0 | M0 | IIC |
| T (*) | N1-3 | M0 | III |
| T (*) | N (*) | M1 | IV |
| * Cualquiera | |||
Otra metodología que suele utilizarse en la clínica es lo que se denomina la detección del «patito feo»: se refiere a aquella lesión pigmentada que difiere del patrón general de lesiones que presenta el paciente.
La satelitosis es un concepto clínico y se la define como la presencia de lesiones clínicamente evidentes de melanoma dentro de un radio de 2 cm respecto del tumor primario.
Las metástasis en tránsito son todas aquellas lesiones de melanoma clínicamente evidentes que se encuentran por fuera del radio de 2 cm del tumor primario y hasta la primera estación ganglionar. La vía de diseminación es linfática.
Siempre se debe evaluar la piel y las mucosas en forma completa.
Ante una lesión sospechosa de melanoma, se debe evaluar además si presenta lesiones compatibles con satelitosis, metástasis en tránsito y adenomegalias regionales.
Diagnósticos diferenciales y simuladores de melanoma
- Nevo melanocítico benigno
- Nevo displásico
- Queratosis seborreica pigmentada o traumatizada
- Carcinoma espinocelular
- Carcinoma basocelular, en especial la variedad pigmentada
- Granuloma piógeno (en especial, con el melanoma amelanótico)
- Tumores metastásicos en la piel
- Fibroxantoma atípico
- Queratosis actínica pigmentada
- Carcinoma sebáceo
Dermatoscopía
La dermatoscopía es un procedimiento de ayuda diagnóstica.
Todas las lesiones deben evaluarse mediante dermatoscopía manual. La sensibilidad y la especificidad para detectar un melanoma son del 90 %. Sin embargo, es operador-dependiente, es decir, depende del entrenamiento que tenga el dermatólogo. Con esta técnica, un profesional entrenado tiene mayor confianza para discriminar lesiones benignas de malignas (mejora la sospecha diagnóstica de lesión maligna) y reduce el número de biopsias o extirpaciones innecesarias.
En pacientes de riesgo, se recomienda hacer la fotografía corporal total combinada con el registro de lesiones por dermatoscopía digital. La fotografía corporal total consiste en el registro fotográfico de las distintas partes del cuerpo. La dermatoscopía digital registra la lesión melanocítica en particular, con un software que permite el almacenamiento de las imágenes. Estos registros posibilitan la observación secuencial del mismo paciente a lo largo del tiempo, la detección temprana de cambios o de nuevas lesiones. El beneficio principal de este estudio es la detección precoz de melanomas.
Confirmación diagnóstica
El examen histológico es el método para lograr el diagnóstico definitivo. Antes de hacer la biopsia, se deben registrar características clínicas de la lesión, sitio anatómico, tamaño; sacar fotografía (sitio correcto para cirugía eventual) y definir el tipo de biopsia.
Técnicas para realizar una biopsia
BIOPSIA ESCISIONAL
Se recomienda una biopsia por escisión completa que abarque la totalidad de la lesión visible y asegurar una profundidad suficiente (para evitar subestimar el espesor real de la lesión), con un margen de 1 a 3 mm. Se debe orientar en dirección paralela al trayecto linfático para no alterar el drenaje ante una ampliación de márgenes/eventual biopsia de ganglio centinela. No deben realizarse biopsias por afeitado superficial, ya que pueden subestimar el espesor lesional.
Biopsia incisional
Está indicada la biopsia parcial en lesiones muy extensas o en regiones anatómicas donde el procedimiento representa una dificultad (por ejemplo, cara, mucosas). La clínica y la dermatoscopía pueden orientar para determinar el sitio donde conviene tomar la biopsia para obtener el mejor rédito diagnóstico. La desventaja de este tipo de biopsias parciales radica en una posible subestimación de los parámetros histológicos que llevará a problemas en la estadificación, conducta terapéutica o pronóstico de la enfermedad.
Hallazgos histológicos
En términos generales, se observan alteraciones a nivel citológico y estructural, las cuales deben evaluarse en conjunto para arribar al diagnóstico de un melanoma.
La atipicidad citológica se refiere a aumento en el tamaño celular y nuclear, pleomorfismo nuclear, heterocromasia nuclear, nucléolos variables y presencia de figuras mitóticas. Las alteraciones a nivel estructural incluyen gran tamaño tumoral, asimetría y ausencia de un claro límite de la neoplasia. Los nidos melanocíticos tienden a confluir; su tamaño y forma son variables. Estos nidos no muestran maduración a medida que descienden hacia la dermis. Los subtipos de melanoma exhiben características particulares.
El melanoma extensivo superficial presenta una proliferación de melanocitos no dendríticos atípicos dispersos en forma individual y agrupados en el espesor del epitelio, lo que se conoce como dispersión «pagetoide». Las células tumorales son del tipo epitelioide, con un citoplasma abundante y una pigmentación melánica fina o de aspecto pulverulento. Sus núcleos son pleomórficos y vesiculosos, y los nucléolos son eosinófilos. El tumor se extiende en continuidad desde una red de cresta a otra, lo cual es característico de esta variante. La epidermis tiende a ser acantósica y muestra un borramiento completo o parcial del patrón de red de crestas.
Por otro lado, el melanoma nodular no muestra una fase de crecimiento radial (no tiene componente intraepidérmico); se caracteriza desde su inicio por una fase de crecimiento vertical.
El lentigo maligno y melanoma lentigo maligno exhiben una proliferación de melanocitos atípicos que se localizan, principalmente, a lo largo de la unión dermoepidérmica. Las células, que muestran núcleos pleomórficos irregulares e hipercromáticos, se orientan en sentido perpendicular a la superficie. Una de las características principales del lentigo maligno es el compromiso del folículo piloso y del epitelio del conducto excretor sudoríparo. A medida que avanza en profundidad, se pueden observar nidos a nivel de la unión dermoepidérmica y células tumorales multinucleadas. El grado de pigmentación es variable: en general, es abundante y puede comprometer todo el espesor de la epidermis. Debido a que este subtipo suele aparecer en zonas fotoexpuestas, la epidermis tiende a ser atrófica y la dermis exhibe elastosis solar. El melanoma lentigo maligno es característicamente multifocal y predominan las células tumorales ahusadas.
El melanoma acral lentiginoso presenta acantosis con una marcada elongación de las crestas epidérmicas y atipicidad melanocítica. En la profundidad de las crestas, se observan melanocitos atípicos, que tienden a ser ahusados, con pleomorfismo nuclear e hipercromasia. Los nucléolos son prominentes. Se pueden observar nidos celulares en focos, a nivel de la unión dermoepidérmica, que le dan su carácter lentiginoso. También pueden afectar el epitelio de las glándulas sudoríparas.
El informe histopatológico debe incluir lo siguiente:
Parámetros principales determinantes de pronóstico
- Espesor tumoral (espesor de Breslow): mide el máximo espesor tumoral desde el estrato granuloso o desde la base de una úlcera hasta la infiltración más profunda de células del melanoma. Se expresa en milímetros con un solo decimal (por ejemplo: 0,1; 1,2 o 2,4 mm). A mayor espesor, peor pronóstico.
- Presencia o ausencia de ulceración: la ulceración es de mal pronóstico.
- Índice mitótico (IM): se expresa en número de mitosis por milímetro cuadrado (mm²). Se utiliza la técnica hot spot que considera que 1 mm² equivale a 3-4 campos microscópicos, y se toman en cuenta los campos que exhiben mayor cantidad de mitosis.
Otros parámetros
- Nivel de invasión de Clark
- I: melanoma in situ (limitado a la epidermis, no se informa el Breslow)
- II: melanoma en dermis papilar
- III: melanoma atraviesa dermis papilar
- IV: melanoma invade dermis reticular
- V: melanoma en hipodermis
- Estado de los márgenes en periferia y en profundidad, como positivos o negativos.
- Microsatelitosis: concepto histopatológico, que se define como cualquier depósito de células tumorales adyacentes o subyacentes al melanoma primario, más allá de su tamaño y de la distancia entre este y el tumor primario, y con un estroma no afectado entre las células tumorales y el tumor primario. Es de mal pronóstico
- Infiltrado linfocitario dentro del tumor
- Fenómeno de regresión
- Fase de crecimiento vertical
- Invasión angiolinfática
- Neurotropismo
Técnicas de inmunohistoquímica: para confirmar el diagnóstico en proliferaciones celulares que no exhiban claramente los indicadores histológicos del melanoma. Se utilizan los marcadores S-100, Melan-A y HMB 45.
Estadificación
Una vez confirmado el diagnóstico, se debe realizar la estadificación oncológica para adecuar el tratamiento al estadio correspondiente. Se utiliza el TNM de la guía del American Joint Committee on Cancer (AJCC), que rige a partir de enero de 2018 (tablas 4a, 4b y 4c).
Tabla 4a
| CLASIFICACIÓN T | ||
| Tx | Tumor primario que no puede ser evaluado | |
| T0 | Sin evidencia del tumor primario | |
| Tis | Melanoma in situ (no se aplica ulceración) | |
| T1 | ≤1,0 mm | a. <0,8 mm sin ulceración |
| b. <0,8 mm con ulceración
0,8 a 1,0 mm con o sin ulceración |
||
| T2 | >1 a 2,0 mm | a. Sin ulceración |
| b. Con ulceración | ||
| T3 | >2 a 4,0 mm | a. Sin ulceración |
| b. Con ulceración | ||
| T4 | >4,0 mm | a. Sin ulceración |
| b. Con ulceración | ||
Tabla 4b
| CLASIFICACIÓN N | |||
| Nx | Ganglios regionales no evaluados (no se realizó BGC, o linfadenectomía previa). Exceptúa: en melanomas T1 no se requiere la categoría N patológica, usar la clínica | ||
| N0 | No se detectan metástasis regionales | ||
| N1 | 1 ganglio comprometido o cualquier metástasis en tránsito, satelitosis y/o microsatelitosis sin compromiso ganglionar | ||
| N1a | 1 clínicamente oculta (detectada por BGC) | ||
| N1b | 1 clínicamente detectada | ||
| N1c | No hay compromiso ganglionar regional, cualquier metástasis en tránsito, satelitosis y/o microsatelitosis | ||
| N2 | 2-3 ganglios comprometidos o cualquier metástasis en tránsito, satelitosis y/o microsatelitosis con compromiso de 1 ganglio | ||
| N2a | 2-3 ganglios clínicamente ocultos | ||
| N2b | 2-3 ganglios clínicamente detectados, o al menos uno clínicamente detectado | ||
| N2c | cualquier metástasis en tránsito, satelitosis y/o microsatelitosis con compromiso de 1 ganglio clínicamente oculto o detectado | ||
| N3 | 4 o más ganglios comprometidos o cualquier metástasis en tránsito, satelitosis y/o microsatelitosis con compromiso de 2 o más ganglios, o ganglios adheridos con o sin metástasis en tránsito, satelitosis y/o microsatelitosis | ||
| N3a | 4 o más ganglios clínicamente ocultos | ||
| N3b | 4 o más ganglios clínicamente detectados, o al menos uno clínicamente detectado o cualquier número de ganglios adheridos | ||
| N3c | 2 o más clínicamente ocultos o detectados y/o cualquier número de ganglios adheridos con cualquier metástasis en tránsito, satelitosis y/o microsatelitosis | ||
Tabla 4c
| CLASIFICACIÓN M | Sitio anatómico | Nivel de LDH | |
| M0 | No hay evidencia de metástasis a distancia. | No aplica | |
| M1 | M1a | Metástasis a distancia en piel, partes blandas incluyendo músculo, y/o ganglios linfáticos no regionales | No registrado |
| M1a (0) | No elevado | ||
| M1a (1) | Elevado | ||
| M1b | Metástasis a distancia en pulmón con o sin afectación de los sitios de M1a | No registrado | |
| M1b (0) | No elevado | ||
| M1b (1) | Elevado | ||
| M1c | Metástasis en órganos distintos al SNC con o sin afectación de los sitios de M1a o M1b | No registrado | |
| M1c (0) | No elevado | ||
| M1c (1) | Elevado | ||
| M1d | Metástasis en SNC* con o sin afectación de los sitios M1a, M1b o M1c | No registrado | |
| M1d (0) | No elevado | ||
| M1d (1) | Elevado | ||
*Fotos 12 y 13
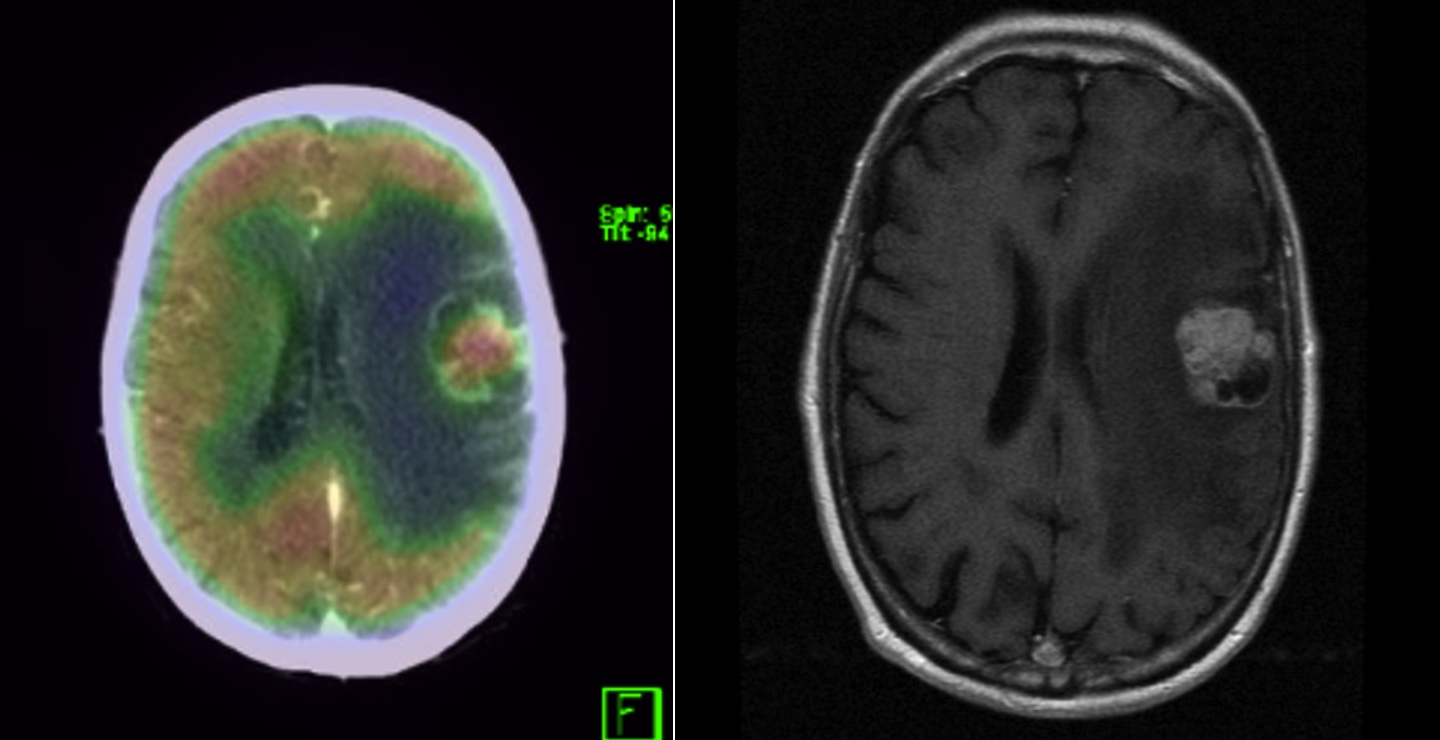
Fotos 12 (PET) y 13 (RNM). Metástasis cerebrales de melanoma (mismo paciente)
Melanoma in situ (Tis) o T1a
En estos casos, no se solicitan estudios de estadificación dado que tienen una muy baja probabilidad de presentar diseminación de la enfermedad más allá del tumor primario.
Melanoma T1b a T4b
A partir de T1b, el riesgo de diseminación aumenta, por lo que se deben realizar estudios complementarios para establecer una correcta estadificación previa a la cirugía y contar con imágenes basales para el seguimiento a futuro.
El T está determinado por los hallazgos histopatológicos del melanoma primario. Para establecer el N y el M, se requieren estudios complementarios, que dependen de la estadificación T.
Estudios complementarios
- Biopsia de ganglio centinela (BGC)
- Ecografía de ganglios regionales
- Tomografía computada de tórax, abdomen y pelvis con doble contraste
- Resonancia magnética de cerebro con contraste
Biopsia de ganglio centinela
Se realiza en un paciente con diagnóstico confirmado de melanoma sin adenomegalias palpables ni evidentes en los estudios de imágenes. Su fin es estadificar, ya que permite la detección de metástasis clínicamente ocultas en los ganglios regionales (N en el TNM). El estado del ganglio centinela (positivo o negativo para metástasis) es uno de los factores pronósticos más importantes para la recurrencia y la sobrevida en pacientes con melanoma. Además, resulta fundamental para determinar la necesidad de un tratamiento adyuvante. Se indica según los siguientes criterios:
Criterios mayores
- Espesor de Breslow igual a 0,8 mm o mayor
- Melanoma ulcerado, más allá de su espesor
- Espesor de Breslow incierto
- Microsatelitosis
- Invasión angiolinfática
- Metástasis en tránsito
Criterios menores
- Edad menor de 40 años (mayor incidencia de micrometástasis ganglionares)
- Índice mitótico: >1
Se debe realizar durante el mismo acto quirúrgico en el que se realiza la resección del tumor con margen, pero antes de la resección del tumor, para evitar la disrupción de los vasos linfáticos y así optimizar la identificación del ganglio centinela correspondiente o los ganglios centinelas correspondientes.
En primer lugar, se realiza un mapeo linfático preoperatorio a través de la linfocentellografía, que consiste en la inyección de un marcador radioactivo (tecnecio-99) alrededor de la lesión para detectar la dirección del drenaje linfático. Posteriormente, durante el acto quirúrgico, se inyecta un colorante azul (azul de metileno) alrededor de la lesión o la cicatriz. Mediante el uso de una sonda (gamma probe) se identifica la zona de drenaje y se remueven el ganglio o los ganglios teñidos de azul. Estos se examinan histológicamente en diferido con hematoxilina-eosina e inmunohistoquímica.
Se define como «compromiso ganglionar» a la presencia de cualquier célula de melanoma en el ganglio o en los canales linfáticos inmediatamente adyacentes al ganglio, más allá de su tamaño.
Se debe informar la presencia de extensión extranodal, que está definida como la presencia de una metástasis ganglionar que se extiende a través de la cápsula del ganglio hacia el tejido adyacente. Si bien puede ser evidente macroscópicamente, esta debe ser confirmada histológicamente.
Ecografía y punción aspiración con aguja fina (PAAF)
Con diagnóstico confirmado de melanoma y adenomegalias regionales palpables, se debe realizar la ecografía de partes blandas (requiere personal entrenado para observar cambios que sugieran enfermedad cancerosa) y posterior punción aspiración con aguja fina para estudio citológico y pesquisa de células neoplásicas del ganglio. Si el resultado es positivo, está indicada la linfadenectomía regional.
Estudio BRAF
Se recomienda estudiar la mutación del gen BRAF en casos de enfermedad metastásica a partir del estadio III. Se busca la mutación BRAF V600 E/K en el tumor primario o en sus metástasis.
Tratamiento
Tratamiento del melanoma primario
Resección quirúrgica del melanoma primario
El tratamiento de elección es la cirugía temprana con un margen adecuado. Permite confirmar histológicamente que los márgenes están libres y reduce el riesgo de persistencia o recurrencia local. El margen lateral está determinado por el espesor tumoral y se delimita en forma clínica alrededor del tumor primario al momento de la cirugía. Se recomienda que la resección llegue hasta la profundidad de la fascia muscular, sin incluirla (tabla 5).
Tabla 5. Márgenes quirúrgicos laterales recomendados en función del espesor tumoral
| Margen lateral en cm | |
| Melanoma in situ | 1 cm |
| ≤1 mm de espesor | 1 cm |
| >1 a ≤2 mm de espesor | 1 a 2 cm (tomar en cuenta la localización anatómica del melanoma) |
| >2 mm de espesor | 2 cm |
Radioterapia
La radioterapia no es la primera opción en el tratamiento del melanoma primario. Puede considerarse en algunos casos, como un paciente de avanzada edad que no se encuentre en condiciones quirúrgicas para resecar un melanoma lentigo maligno de la cara.
Tratamiento de la enfermedad ganglionar y a distancia
Si hay compromiso ganglionar clínico (ecografía patológica y PAAF +) con metástasis, se sugiere proceder a la linfadenectomía completa.
Ante el hallazgo de un ganglio centinela (GC) positivo, es decir, una metástasis ganglionar clínicamente oculta, se debe discutir en forma multidisciplinaria cuál es la conducta que se va a tomar: linfadenectomía o control ecográfico periódico. La linfadenectomía se acompaña de cierta morbilidad; podría proponerse ante el hallazgo de una gran carga tumoral en el GC, o de varios GC afectados y/o de la presencia de parámetros de mal pronóstico en el melanoma primario.
Ante la evidencia de metástasis o progresión de la enfermedad, corresponde también evaluar la posibilidad del tratamiento adyuvante. Se debe considerar a partir del estadio III; hay que tener en cuenta el riesgo de recurrencia de la enfermedad y las posibles toxicidades del tratamiento.
Terapias dirigidas antitumorales
Se administran a partir del estadio III en presencia de la mutación del gen BRAF V600E/K. Se combina un inhibidor de BRAF con un inhibidor de MEK. La combinación de dabrafenib/trametinib se indica en estadios IIIA con tumor ulcerado y/o una carga tumoral ganglionar mayor de 1 mm y en estadio IIIB/C. En el estadio IV se puede indicar las combinaciones dabrafenib/trametinib, vemurafenib/cobimetinib o encorafenib/binimetinib.
Inhibidores BRAF (del protooncogén B-Raf): dabrafenib, vemurafenib y encorafenib; se administran por vía oral.
Inhibidores MEK (mitogen-activated protein kinase-kinase): trametinib, cobimetinib y binimetinib; se administran por vía oral.
Inmunoterapia
Es un tratamiento que busca mejorar la respuesta inmunitaria antitumoral del huésped. Se usan nivolumab o pembrolizumab en monoterapia a partir del estadio III; también la combinación de nivolumab/ipilimumab en determinadas circunstancias.
- Anti-PD1 (Programmed death 1: muerte programada 1)
Nivolumab y pembrolizumab: se administran en forma endovenosa.
- Anti-CTLA 4 (Cutaneous cytotoxic T lymphocyte antigen 4: antígeno cutáneo de linfocitos T citotóxicos 4)
Ipilimumab: se administra en forma endovenosa. Se usa como adyuvante en pacientes con enfermedad metastásica que fueron expuestos a anti-PD1.
Radioterapia
Se indica sobre la base de la localización, el número y el tamaño de ganglios afectados, y, en especial, de la presencia de extensión extracapsular. Si bien reduce la recurrencia tumoral, no ha demostrado mejorar la sobrevida libre de recaída ni la sobrevida global. No está exenta de morbilidad como el linfedema. La radioterapia es una opción ante la presencia de metástasis cerebrales.
Manejo de las satelitosis y metástasis en tránsito
Se sugiere la resección quirúrgica y el tratamiento sistémico. Como otras alternativas, se cuenta con tratamientos intralesionales; por ejemplo, el T-VEC (talimogene laherparepvec), IFN, BCG, o IL‑2; imiquimod tópico; radioterapia; o perfusión hipertérmica de una extremidad con melfalán.
Estadificación final
Una vez realizado el diagnóstico de certeza mediante la histopatología, así como los estudios de imágenes, y llevado a cabo el tratamiento quirúrgico, se debe efectuar la estadificación final de acuerdo con los datos obtenidos. Para ello, se utilizarán los criterios de la AJCC mencionados anteriormente (tabla 6).
Tabla 6. Estadificación patológica
| T | N | M | Estadio patológico |
| Tis | N0* | M0 | 0 |
| T1a | N0 | M0 | IA |
| T1b | N0 | M0 | IA |
| T2a | N0 | M0 | IB |
| T2b | N0 | M0 | IIA |
| T3a | N0 | M0 | IIA |
| T3b | N0 | M0 | IIB |
| T4a | N0 | M0 | IIB |
| T4b | N0 | M0 | IIC |
| T0 | N1b,N1c | M0 | IIIB |
| T0 | N2b, N2c, N3b o N3c | M0 | IIIC |
| T1a/b-T2a | N1a o N2a | M0 | IIIA |
| T1a/b-T2a | N1b/c o N2b | M0 | IIIB |
| T2b/T3a | N1a-N2b | M0 | IIIB |
| T1a-T3a | N2C o N3a/b/c | M0 | IIIC |
| T3b/T4a | Cualquier N ≥1 | M0 | IIIC |
| T4b | N1a-N2c | M0 | IIIC |
| T4b | N3a/b/c | M0 | IIID |
| Cualquier T | Cualquier N | M1 | IV |
| *Los estadios 0 y T1 no requieren evaluación patológica de ganglios linfáticos para completar la estadificación patológica. Usar información clínica de N clínico para asignar el estadio | |||
Toma en cuenta la estadificación clínica, considera la información obtenida por una BGC y/o una posterior linfadenectomía.
Seguimiento
El paciente debe ingresar a un plan de control y seguimiento de por vida, con un enfoque multidisciplinario. Esto se llevar a cabo con éxito en Unidades de Melanoma hospitalarias interdisciplinarias. Es necesario tener en cuenta que un paciente con el antecedente de melanoma presenta un mayor riesgo de desarrollar un segundo melanoma, y el riesgo de una recurrencia local, regional y a distancia (esta última depende del estadio final). Por ello, se clasifica al paciente en bajo, mediano y alto riesgo (tablas 7 y 8a, 8b y 8c).
Tabla 7. Estratificación del riesgo en función de la estadificación final
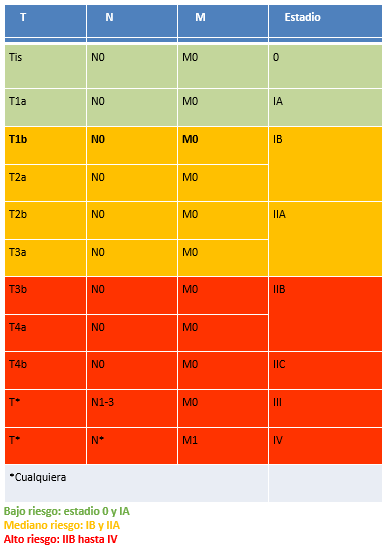
Tabla 8a. Seguimiento de melanomas de bajo riesgo. Estadios 0 y IA
| Recomendación | Frecuencia |
| Fomentar el autoexamen
Medidas de fotoprotección Examen físico: piel, cuero cabelludo y mucosas, palpación de cicatriz de melanoma, vía linfática, ganglios regionales, ganglios no regionales y vísceras Dermatoscopía manual de lesiones cutáneas |
Cada 6 meses por 5 años
Luego cada 12 meses |
| Ecografía de ganglios regionales
Punción con aguja fina guiada por ecografía para estudio citológico (PAAF) |
En caso de adenopatía palpable
Ante el hallazgo de adenopatía sospechosa de metástasis |
| Fotografía corporal total + Dermatoscopía digital secuencial | Anual |
Tabla 8b. Seguimiento de melanomas de mediano riesgo. Estadios IB y IIA
| Recomendación | Frecuencia |
| Fomentar el autoexamen
Medidas de fotoprotección Examen físico: piel, cuero cabelludo y mucosas, palpación de cicatriz de melanoma, vía linfática, ganglios regionales, ganglios no regionales y vísceras Dermatoscopía manual de lesiones cutáneas |
Cada 3 meses por 5 años Luego cada 6 meses |
|
Ecografía de ganglios regionales Punción con aguja fina guiada por ecografía para estudio citológico (PAAF) |
Cada 6 meses
Ante el hallazgo de adenopatía sospechosa de metástasis |
| Estudios de imágenes | En función del examen físico/síntomas |
| Fotografía corporal total + Dermatoscopía digital secuencial | Anual |
Tabla 8c. Seguimiento de melanomas de alto riesgo. Estadios IIb hasta IV
| Recomendación | Frecuencia |
| Fomentar el autoexamen
Medidas de fotoprotección Examen físico: piel, cuero cabelludo y mucosas, palpación de cicatriz de melanoma, vía linfática, ganglios regionales, ganglios no regionales y vísceras Dermatoscopía manual de lesiones cutáneas |
Cada 3 meses por 5 años Luego cada 6 meses |
| Estudio molecular del tejido (BRAF) a partir de estadio III | |
| Ecografía de ganglios regionales
Ecografía de ganglios no regionales Punción con aguja fina guiada por ecografía para estudio citológico (PAAF) |
Cada 6 meses
En caso de adenopatía palpable Ante el hallazgo de adenopatía sospechosa de metástasis |
| TAC doble contraste de tórax, abdomen y pelvis + RNM cerebro, con contraste + PET/TC corporal total (solicitar con y sin corrección de atenuación) | Anual |
| Fotografía corporal total + Dermatoscopía digital secuencial | Anual |
| Hepatograma, LDH (a partir de estadio IV) | Cada 6 meses |
Concepto de persistencia tumoral y de recurrencia tumoral
La persistencia tumoral es la presencia de un componente de melanoma in situ y/o una fase de crecimiento radial dentro de la cicatriz o adyacente a ella.
La recurrencia tumoral es la presencia de un componente de melanoma en dermis o tejido celular subcutáneo dentro de la cicatriz o adyacente a ella, en ausencia de un componente in situ o una fase de crecimiento radial.
Situaciones especiales
Melanoma y embarazo
Durante muchos años, se discutió si el embarazo podría empeorar el pronóstico. La evidencia demostró que no influye en el curso del tumor, ni en el pronóstico de sobrevida global. Las mujeres en edad fértil con diagnóstico de melanoma de alto riesgo deben ser informadas de los factores de mal pronóstico conocidos; si estos estuviesen presentes, se sugiere postergar un embarazo por tres años. Se debe explicar a la paciente la necesidad de realizar periódicamente la estadificación con estudios de imágenes que podrían ser perjudiciales para el producto de la concepción. De todas maneras, siempre se debe respetar la autonomía para decidir de la paciente.
Melanoma y terapias hormonales
Ni las hormonas de reemplazo ni los contraceptivos hormonales modifican el curso de la enfermedad; por lo tanto, no están contraindicados en pacientes con antecedente de melanoma.
Melanomas primarios múltiples
En estas situaciones, cada tumor primario es categorizado por separado. Para la estadificación del paciente, se utilizará el estadio del tumor de mayor grado.
Puntos clave
- El melanoma es un tumor maligno que representa alrededor del 1 % de los tumores cutáneos, es de estirpe melanocítica y tiene una alta capacidad metastatizante.
- Su etiopatogenia es multifactorial; los principales factores de riesgo son la predisposición genética y la radiación ultravioleta.
- Los factores de riesgo incluyen fototipos bajos, cabello rubio o rojizo, ojos claros, el antecedente personal de múltiples nevos melanocíticos, nevos atípicos o nevos displásicos resecados, el antecedente personal de un melanoma previo, el antecedente familiar de melanoma, especialmente en familiares de primer grado, y la exposición a radiación ultravioleta.
- Los subtipos clínicos son el melanoma extensivo superficial, el melanoma nodular, el melanoma acral lentiginoso y el melanoma lentigo maligno.
- El acrónimo ABCDE es útil para orientar la sospecha clínica: Asimetría, Bordes irregulares, Coloración heterogénea, Diámetro mayor de 6 mm y Evolución en el tiempo.
- La dermatoscopía manual es fundamental para el estudio de lesiones cutáneas sospechosas de melanoma, con una sensibilidad y especificidad del 90 %.
- El diagnóstico definitivo se realiza mediante una biopsia apropiada y su estudio histopatológico.
- Los factores pronósticos principales son el espesor tumoral (Breslow), la ulceración y el índice mitótico en el melanoma primario, y la presencia de metástasis regional y sistémicas.
- El tratamiento del melanoma primario es quirúrgico. La detección temprana y un tratamiento precoz mejoran la sobrevida.
- Una adecuada estadificación es importante para indicar el tratamiento y el plan de seguimiento, sobre la base de la posibilidad de recurrencia local, regional y a distancia.
Bibliografía recomendada
American Cancer Society (2019) Key Statistics for Melanoma Skin Cancer. http://www.cancer.org/cancer/melanoma-skin-cancer/about/key-statistics.html
Loria D, Abriata MG, Santoro F, Latorre C. Cutaneous melanoma in Argentina: An analysis of its characteristics and regional differences. E-cancer. 2020;14:1017.
Shain, AH, et al. Genomic and Transcriptomic Analysis Reveals Incremental Disruption of Key Signaling Pathways during Melanoma Evolution. Cancer Cell. 2018;34(1):45-55.e4.
Hayward NK, et al. Whole-genome landscapes of major melanoma subtypes. Nature. 2017;545(7653):175-180.
Khan AQ, et al. Roles of UVA Radiation and DNA Damage Responses in Melanoma Pathogenesis. Environ Mol Mutagen. 2018;59(5):438-460.
Burns D, et al. The Pathogenesis and Clinical Management of Cutaneous Melanoma: An Evidence-Based Review. Journal of Medical Imaging and Radiation Sciences. 2019;50(3):460-469.e1.
Elder DE, Massi D, Soclyer RA, Willemze R (eds.). WHO Classification of Skin Tumours, WHO Classification of Tumours, 4ª edición, Volumen 11; 2018. 978-92-832-2440-2.
Rabbie R, Ferguson P, Molina-Agular C, Adams DJ, Robles-Espinoza C. Melanoma subtypes: Genomic profiles, prognostic molecular markers and therapeutic possibilities. J Pathol. 2019;247:539-551.
Watts CG, Dieng M, Morton RL, Mann GJ, Menzies SW, Cust, AE. Clinical practice guidelines for identification, screening and follow‐up of individuals at high risk of primary cutaneous melanoma: A systematic review. Br J Dermatol. 2015;172(1):33-47.
Ransohoff K, et al. Familial skin cancer syndromes. Increased melanoma risk. J Am Acad Dermatol. 2016;74:423-434. http://dx.doi.org/10.1016/j.jaad.2015.09.070.
Swetter SM, et al. Guidelines of care for the management of primary cutaneous melanoma. J Am Acad Dermatol. 2019;80(1):208-250.
Gandini S, Sera F, Cattaruzza MS, et al. Meta-analysis of risk factors for cutaneous melanoma. II. Sun exposure. Eur J Cancer. 2005;41(1):45-60.
Li Y, et al. Second primary melanomas: Increased risk and decreased time to presentation in patients exposed to tanning beds. J Am Acad Dermatol. 2018;79.6:1101-1108.
Lazovich D, et al. Indoor tanning and risk of melanoma: A case-control study in a highly exposed population. Cancer Epidemiol Biomarkers Prev. 2010;19(6):1557-1568.
O’Sullivan D, et al. Indoor tanning and skin cancer in Canada: A meta-analysis and attributable burden estimation. Cancer epidemiology. 2019;59:1-7.
Rigel DS, Russak J, Friedman R. The Evolution of Melanoma Diagnosis: 25 Years Beyond the ABCDs. CA Cancer J Clin. 2010;60(5):301-316.
Scopa A. The «ugly duckling» sign. Arch Dermatol. 2008;144(1):58-64.
Vestergaard ME, Macaskill P, Holt PE, Menzies SW. Dermoscopy compared with naked eye examination for the diagnosis of primary melanoma: A meta-analysis of studies performed in a clinical setting. Br J Dermatol. 2008;159:669-676.
Salerni G, Carrera C, Lovatto L, Puig Butille JA, Badenas C, Plana E, Puig S, Malvehy J. Benefits of total body photography and digital dermatoscopy («two-step method of digital follow-up») in the early diagnosis of melanoma in patients at high risk for melanoma. J Am Acad Dermatol. 2012;67:17-27.
Swetter SM, Tsao H, Bichakjian CK, Curiel-Lewrandoski C, et al. Guidelines of care for the management of primary cutaneous melanoma. J Am Acad Dermatol. 2019;80(1):208-250.
Gershenwald GE, Scolyer RA, Hess KR, Sondak VK, et al. Melanoma Staging: Evidence-Based Changes in the American Joint Committee on Cancer Eighth Edition Cancer Staging Manual. CA Cancer J Clin. 2018;67(6):472-492.
McKee PH, Calonje E, Granter SR. Pathology of the Skin: with clinical correlations. 3ª edición. Londres, Reino Unido: Elsevier Limited; 2005.
Faries MB, Thompson JF, Cochran AJ, Andtbacka RH, et al. Completion Dissection or Observation for Sentinel-Node Metastasis in Melanoma. N Engl J Med. 2017;376(23):2211-2222.
National Comprehensive Cancer Network. Melanoma (Versión 2.2019). Acceso el 22 de septiembre de 2019.


