El origen del cáncer
Hace más de treinta años, se esbozó por primera vez la teoría de que el cáncer ocurre por la mutación secuencial y acumulativa de oncogenes o genes supresores de tumor. Según esta hipótesis, las lesiones precursoras de tumores deberían tener algunas de las mutaciones, aunque no todas, presentes en el tumor.
En la actualidad, se sostiene que el cáncer resulta de la acumulación secuencial de mutaciones en genes supresores, oncogenes y genes que codifican miARN (microARN). Esta acumulación progresiva de mutaciones en genes clave que regulan la proliferación, la diferenciación y la muerte celular lleva a la proliferación celular descontrolada. Estas alteraciones suelen ser eventos somáticos (adquiridos solo por el tumor), aunque en algunos casos ciertas alteraciones genéticas en la línea germinal pueden predisponer al cáncer hereditario o familiar. Una sola alteración genética es, por lo general, insuficiente para desarrollar un tumor maligno, y la evidencia sugiere que el desarrollo de una célula cancerosa es un proceso escalonado de varios pasos que involucra alteraciones sucesivas, las cuales otorgan a la célula cancerosa una ventaja selectiva de crecimiento en un microambiente en particular.
La secuenciación genómica completa reveló que cada tumor posee cientos de mutaciones genéticas somáticas y alteraciones epigenéticas que no están presentes en la línea germinal. Solo una muy pequeña fracción de estas mutaciones ocurre en los genes driver (conductores, determinantes), los que, una vez mutados, confieren a la célula tumoral una «ventaja proliferativa selectiva» sobre las células que la rodean, mientras que la gran mayoría de las otras mutaciones son pasajeras. Hasta la fecha, se han encontrado 299 genes capaces de actuar como genes driver, que, en general, regulan vías o señales que influyen en la proliferación o destino celular (apoptosis, senescencia).
Las mutaciones somáticas y los eventos epigenéticos son estocásticos (azarosos, el precio que la célula debe pagar cada vez que entra en división), que ocurren raramente, en el orden de 107 por gen, en cada ciclo de duplicación de ADN. Afortunadamente, la mayoría de las mutaciones producidas son irrelevantes (pasajeras) y no confieren ningún riesgo para desarrollar cáncer. Los factores hereditarios y ambientales (radiación UV, tabaco), a través de sus efectos tanto en la tasa de mutaciones como en el número de células en división, juegan un rol fundamental en el riesgo de desarrollar cáncer y pueden predominar sobre el azar.
Los genes driver deben entenderse a nivel de la vía de señal proliferativa en la que operan, más que a nivel individual. Por ejemplo, en el melanoma, las mutaciones en los genes BRAF y NRAS afectan la misma vía y son mutuamente excluyentes a nivel celular en el proceso de transformación (figura 1).
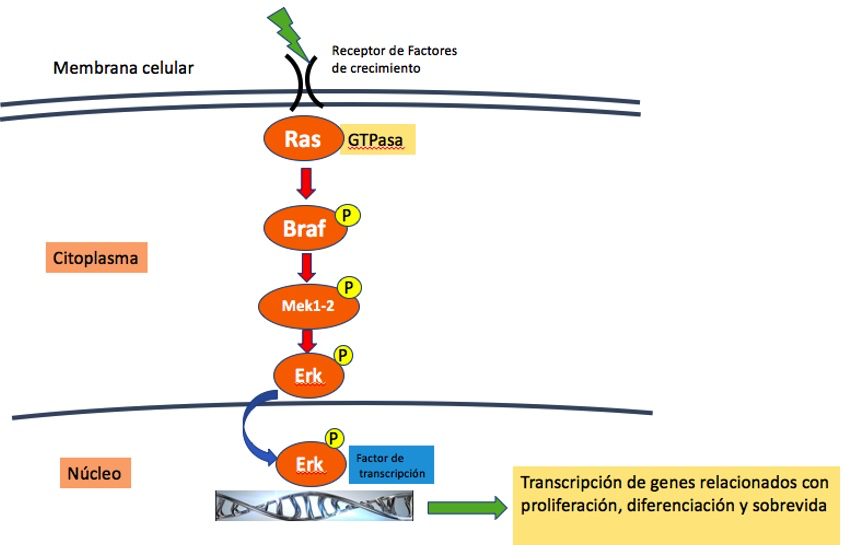
Figura 1. Vía proliferativa MAPKKK, Ras-Raf-MEK-ERK. BRAF es una enzima (serina/treonina-quinasa) que modula la actividad de otras proteínas a través de la fosforilación. BRAF es activada por Ras, una GTPasa, y a su vez activa a MEK y a ERK (extracellular signal regulated kinase) en forma secuencial, promoviendo la expresión génica, la proliferación y diferenciación celular.
Diferentes combinaciones de alelos mutados están presentes en genomas de diversos tipos de tumores, así como en diversos tipos de cánceres del mismo tejido. Pese a la cantidad y diversidad de los alelos mutados, las funciones de estos genes se pueden agrupar en un número limitado de principios bioquímicos y biológicos vinculados a roles significativos en la transformación maligna. La transformación experimental de células humanas indica que hay vías regulatorias clave, cuya disrupción imparte un fenotipo maligno a células normales. De esto surge que hay principios genéticos y vías biológicas celulares comunes que gobiernan la mayoría de los cánceres en humanos. La patogénesis del cáncer puede entenderse, entonces, sobre la base de estas vías regulatorias de circuitos celulares, como alteraciones en operaciones celulares clave, limitadas en número, que gobiernan la mayoría de las células tumorales humanas.
Terapia dirigida al blanco o terapia personalizada
El conocimiento de que ciertos tumores tenían determinadas vías de señalización predominantemente «encendidas» llevó a la idea de desarrollar drogas que selectivamente inhibieran los oncogenes activados en las vías. La estrategia de la terapia personalizada se basa en la utilización de drogas dirigidas contra blancos mutados, presentes solo en el tejido tumoral de algunos pacientes.
Melanoma cutáneo
El descubrimiento del oncogén BRAF fue un hito en la historia del tratamiento del melanoma. El conocimiento de que este oncogén está mutado en el 40 a 60 % de los casos de melanoma cutáneo y que las mutaciones llevan a la activación constitutiva de la vía de las MAPK (MAP quinasas) —la vía proliferativa más importante en los tumores en general—, así como que el 90 % de estas mutaciones corresponden a BRAFV600E, aunque hay otras mutaciones activantes como BRAFV600K y BRAFV600R, condujo al desarrollo de drogas que inhibiesen selectivamente estas formas mutadas del oncogén BRAF, pero no su forma salvaje (wild type).
El vemurafenib es una molécula pequeña biodisponible en forma oral que inhibe las formas mutadas BRAFV600E y BRAFV600K, uniéndose al sitio de unión del ATP e inhibiendo su actividad quinasa. Remisiones muy rápidas se observaron con el vemurafenib, con una media de tiempo de respuesta de solo 1,45 meses (tabla 1).
El vemurafenib se convirtió en una pieza clave en el tratamiento del melanoma metastásico y fue aprobado para su uso por la FDA (Federal Drug Administration) en 2011.
El dabrafenib es otra molécula biodisponible por vía oral, aprobada por la FDA en 2013, que inhibe algunas formas mutadas del oncogén BRAF, como BRAFV600E y BRAFV600K. Pese a su rápida respuesta inicial, el desarrollo de resistencia limita la duración de las respuestas clínicas. Con el fin de disminuir la resistencia a los inhibidores de BRAF, se los asocia a inhibidores de MEK (quinasa «río abajo» de BRAF), como trametinib o cobimetinib, con buenos resultados clínicos.
Carcinoma basocelular
Otro ejemplo de terapia dirigida al blanco se da en carcinomas basocelulares. La vía de señalización de Hedgehog cumple un rol muy importante en el desarrollo de estos tumores. Esta vía, muy activa en el desarrollo embrionario, se encuentra inactiva en tejidos adultos, debido a que la proteína transmembrana PTCH1 (Patched 1) inactiva a otra proteína transmembrana, SMO (Smoothened), que es la que genera la activación de la vía y la transcripción de genes relacionados con la replicación celular en el núcleo. Cuando ocurren mutaciones en el gen supresor de tumor PTCH1, se pierde la función inhibitoria de este sobre SMO y se genera una proliferación descontrolada de células basales.
El vismodegib, una molécula pequeña, primera en su tipo capaz de inhibir SMO, ha probado ser de utilidad en el tratamiento del carcinoma basocelular inoperable, localmente avanzado o metastásico (tabla 1).
Tabla 1. Ejemplos de drogas dirigidas al blanco, antioncogenes
| Droga | Blanco terapéutico | Vía de señalización | Usos |
| Vemurafenib
Dabrafenib Encorafenib |
BRAF mutado | MAPK (MAP quinasas) | Melanoma metastásico y adyuvancia |
| Trametinib
Cobimetinib Binimetinib |
Mek | MAPK (MAP quinasas) | Melanoma metastásico y adyuvancia |
| Vismodegib | SMO | Hedgehog | Carcinoma basocelular metastásico o localmente avanzado |
Inmunidad antitumoral y tratamientos contra los puntos de control inmune
Si bien, en ocasiones, el sistema inmune (SI) es capaz de eliminar células tumorales por considerarlas extrañas, muchas veces estas son reconocidas como propias. Esta tolerancia entre el SI y el cáncer es mantenida por diversos mecanismos: células regulatorias inmunes, citoquinas inmunosupresoras y los llamados «puntos de control inmune». La capacidad de evadir el sistema inmune constituye uno de los rasgos característicos que adquieren las células tumorales para sobrevivir en el huésped.
Los puntos de control inmune (immune checkpoints) que operan limitando las funciones del SI son el eje CTLA4-B7, que interviene en la inactivación de los linfocitos T naive en los ganglios linfáticos, y el eje PD1-PDL1, que opera en el microambiente tumoral deprimiendo la función de los linfocitos T CD8 citotóxicos. En ambos casos, el resultado final es la producción de linfocitos exhaustos (anérgicos), incapaces de ejercer su función antitumoral.
La comprensión de estos mecanismos posibilitó el desarrollo de herramientas terapéuticas dirigidas contra los puntos de control inmune (anti-immune checkpoints). Su finalidad es revertir el estado exhausto de los linfocitos T CD4+ o CD8+ activados, y uno de sus principales efectos colaterales es, lógicamente, la autoinmunidad.
La secuenciación de genomas en cáncer suele revelar cientos de mutaciones somáticas que generan cambios aminoacídicos en las proteínas. La gran mayoría de estas mutaciones son pasajeras, ya que su impacto funcional en la proteína es bajo, o bien la proteína afectada no es relevante para la progresión tumoral. Las mutaciones pasajeras no otorgan una «ventaja proliferativa a la célula», pero ocurren de manera coincidente o subsiguiente a las mutaciones en los genes driver (determinantes) en el camino hacia la tumorigénesis y, por ende, se encuentran, en mayor o menor medida, en todas las células tumorales. Las mutaciones pasajeras, aunque no sean driver, son capaces de actuar como neoantígenos tumorales, ser reconocidos por linfocitos T efectores citotóxicos y, en consecuencia, generar una respuesta inmune antitumoral. Por lo tanto, la alta tasa mutacional podría ser una condición favorable, aunque no determinante, de una buena respuesta a los tratamientos con inhibidores de los puntos de control inmunes.
La detección de una carga mutacional alta es planteada, en la actualidad, como un biomarcador capaz de predecir la respuesta favorable de los tumores a los tratamientos contra los puntos de control inmunes, como anti-CTLA4 o anti-PD1-PDL1, ya que se supone que son estos casos los que poseen una respuesta inmune antitumoral preexistente, pasible de ser desinhibida.
El ipilimumab, un anticuerpo monoclonal (ACM) de tipo IgG1, y el tremelimumab, un ACM tipo IgG2, anti-CTLA4, bloquean el primer punto de control inmune (eje CTLA4-B7) y, por ende, actúan tempranamente en el montado de la respuesta inmune (ganglios linfáticos). Además, disminuyen la actividad de los linfocitos Treg (T regulatorios, inmunosupresores), que poseen la molécula CTLA4 constitutivamente expresada en su superficie (tabla 2).
El nivolumab y el pembrolizumab son ACM anti-PD1 utilizados en pacientes con melanoma metastásico y en adyuvancia, y el avelumab es un ACM anti-PDL1 que se utiliza en carcinoma de Merkel metastásico. En todos estos casos, el objetivo es revertir el estado exhausto de los linfocitos T citotóxicos dentro del tumor, con el fin de que ejecuten su acción antitumoral. En el caso del avelumab, al estar dirigido contra PDL1, expresado en las células tumorales, además de interrumpir el eje inhibitorio PD1-PDL1, por tratarse de una IgG1, es capaz de ejercer citotoxicidad celular mediada por anticuerpos (ADCC) y contribuir, de esta manera, a la lisis de las células tumorales (tabla 2).
Tabla 2. Ejemplos de drogas dirigidas contra los checkpoints inmunes
| Droga | Blanco terapéutico | Eje inhibido | Usos |
| Nivolumab | PD1 | PD1-PDL1 | Melanoma metastásico y adyuvancia |
| Pembrolizumab | PD1 | PD1-PDL1 |
Melanoma metastásico y adyuvancia Carcinoma de Merkel |
| Avelumab | PDL1 | PD1-PDL1 | Carcinoma de Merkel |
| Ipilimumab
Tremelimumab |
CTLA4 | CTLA4-B7 | Melanoma metastásico y adyuvancia |
La terapia dirigida contra oncogenes activados y la inmunoterapia han cambiado los paradigmas de tratamiento en oncología, contribuyendo de manera sustancial al avance del largo camino por recorrer de la medicina personalizada.
Puntos clave
- El cáncer resulta de la acumulación secuencial y progresiva de mutaciones en genes supresores de tumor, oncogenes y genes que codifican miRNA (microARN). Esta afectación de genes clave que regulan la proliferación, la diferenciación y la muerte celular lleva a la proliferación celular descontrolada.
- Las mutaciones que originan el cáncer suelen ser eventos somáticos (propios del tumor), aunque en ocasiones mutaciones de origen germinal pueden predisponerlo.
- Existen vías regulatorias clave, limitadas en número, cuya disrupción imparte un fenotipo maligno a células normales. Algunos tumores tienen determinadas vías de señalización predominantemente «encendidas».
- La estrategia de la terapia personalizada se basa en la utilización de drogas dirigidas contra blancos mutados en los tumores, apagando las vías de señal que se encuentran «encendidas» (activadas en forma permanente).
- El oncogén BRAF, mutado en el 40 a 60 % de los casos de melanoma cutáneo, lleva a la activación constitutiva de la vía de las MAPK (Map quinasas). Drogas dirigidas contra este se emplean en el tratamiento del melanoma metastásico y en adyuvancia.
- El vismodegib, una molécula pequeña utilizada en el tratamiento del carcinoma basocelular inoperable, localmente avanzado o metastásico, interrumpe la vía Hedgehog, activada en ellos.
- Los puntos de control inmune (immune checkpoints) son vías inhibitorias que limitan las funciones del sistema inmunitario, con el fin de apagar la respuesta inmune y evitar el daño tisular innecesario, una vez que cedió el agente agresor.
- Los puntos de control inmune más relevantes son el eje CTLA4-B7 en los ganglios linfáticos y el eje PD1-PDL1 en el microambiente tumoral. En ambos casos, su función es generar linfocitos anérgicos o exhaustos, apagando la respuesta inmune o impidiendo que los linfocitos T CD8 citotóxicos destruyan células tumorales.
- Existen drogas que revierten el freno en los puntos de control inmune, lo que deriva en la producción de linfocitos permanentemente activados, capaces de ejercer su función antitumoral.
Bibliografía recomendada
Vogelstein B y Kinzler KW. The Path to Cancer — Three Strikes and You’re Out. N Engl J Med. 2015;373(20):1895-1898.
Croce CM. Oncogenes and cancer. N Engl J Med. 2008;358(5):502-511.
Sanchez-Vega F, Mina M, Armenia J, et al. Oncogenic Signaling Pathways in The Cancer Genome Atlas. Cell. 2018;173(2):321-337.
Liu LS. Colegio O.R. Molecularly targeted therapies for melanoma. International Journal of Dermatology. 2013;52:523-530.
Larkin J, Ascierto PA, Dréno B, et al. Combined Vemurafenib and Cobimetinib in BRAF -Mutated Melanoma. New England Journal of Medicine. 2014;371(20):1867-1876.
Sekulic A, Migden MR, Oro AE, et al. Efficacy and Safety of Vismodegib in Advanced Basal-Cell Carcinoma. N Engl J Med. 2012;366:2171-2179.
Madorsky Rowdo FP, Baron A, Urrutia M, et al. Immunotherapy in cancer: A combat between tumors and the immune system; you win some, you lose some. Frontiers in Immunology. 2015;6(MAR):2-13
Ribas A. Releasing the Brakes on Cancer Immunotherapy. N Engl J Med. 2015;373(16):1490-1492.
Mordoh A. Entendiendo el eje PD1-PDL1. Un nuevo blanco terapéutico en el tratamiento del cáncer. Act Terap Dermatol. 2019;42:144-147.


