Cáncer de piel en el trasplante de órgano sólido
Epidemiología
La incidencia de cáncer de piel en los pacientes con trasplante de órgano sólido (TOS) es mayor que en la población general y cambia de acuerdo con el tiempo transcurrido luego del trasplante (tabla 1 y gráfico 1). Del 10 al 24 % de los pacientes trasplantados desarrollará cáncer de piel dentro de los primeros 20 años luego del trasplante y entre el 40 y el 60 % habrá presentado al menos un tumor en el transcurso de los primeros 30 años.
Tabla 1. Incremento en la incidencia de cáncer de piel en pacientes trasplantados con respecto a la población general
| Tipo de cáncer de piel | Incremento de la incidencia |
| Carcinoma espinocelular | 65 a 250 veces |
| Carcinoma basocelular | 10 a 16 veces |
| Sarcoma de Kaposi | 84 a 500 veces |
| Carcinoma de células de Merkel | 24 veces |
| Melanoma | 0 a 8 veces |
Elaborada sobre la base de Jensen P, Hansen S, Moller B, Leivestad T, Pfefer P, Geiran O, et al. Skin cancer in kidney and heart transplant recipients and different long-term immunosuppressive therapy regimens. J Am Acad Dermatol. 1999;40:177-186; Hartevelt MM, Bavinck JN, Kootte AM, Vermeer BJ, Vandenbroucke JP. Incidence of skin cancer after renal transplantation in The Netherlands. Transplantation. 1990;49:506-509; Harwood, et al. The pathogenesis of cutaneous squamous cell carcinoma in organ transplant recipients. Br J Dermatol. 2017;177(5):1217-1224.
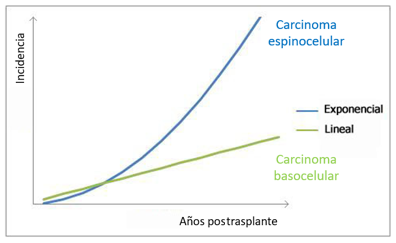 Gráfico 1. Crecimiento en la incidencia de carcinoma basocelular y espinocelular en pacientes trasplantados
Gráfico 1. Crecimiento en la incidencia de carcinoma basocelular y espinocelular en pacientes trasplantados
Los cánceres de piel más frecuentes en esta población son el carcinoma espinocelular (CEC) (foto 1) y el carcinoma basocelular (CBC), que comprenden del 90 al 95 % de los casos, con una inversión en la relación en la incidencia de ambos tipos tumorales (CEC/CBC 6:1).

Foto 1. Carcinoma espinocelular moderadamente diferenciado en un paciente trasplantado hepático
Con mucha menor frecuencia, aunque con una incidencia mayor que en la población general, los pacientes con TOS pueden presentar sarcoma de Kaposi, carcinoma de células de Merkel y melanoma.
Etiopatogenia
La etiopatogenia del cáncer de piel en los pacientes con TOS es compleja y se encuentra en continuo estudio. Los factores de riesgo para su desarrollo se agrupan en aquellos relacionados con el paciente, con la inmunosupresión y con los antecedentes del trasplante (tabla 2).
Tabla 2. Factores de riesgo para cáncer de piel en los pacientes con TOS
Relacionados con el paciente
|
Relacionados con la inmunosupresión
|
Relacionados con los antecedentes patológicos
|
Estos factores de riesgo se interrelacionan y contribuyen al desarrollo del CEC (gráfico 2). El virus del papiloma humano (VPH) tiene un rol destacado y su conocimiento ha sido motivo de constantes investigaciones en los últimos años. El 90 % de los pacientes trasplantados desarrolla verrugas virales y existe evidencia de la progresión clínica e histológica de estas a lesiones displásicas y carcinoma espinocelular invasor. Por su parte, la detección de VPH, con un predominio de los VPH beta (VPH 5, 8, 20, 75 y 76), en el CEC en pacientes trasplantados, es del 75 %, mientras que en la población general esto alcanza solo al 37 %. El modelo de hit and run postula que la presencia de ADN viral no es requerida de forma persistente a lo largo de todo desarrollo tumoral, sino que es condición necesaria inicial para facilitar otras mutaciones que serán inducidas por el efecto carcinogénico de los fármacos inmunosupresores y la radiación UV. Los demás factores detallados también favorecen al desarrollo de CBC y melanoma.
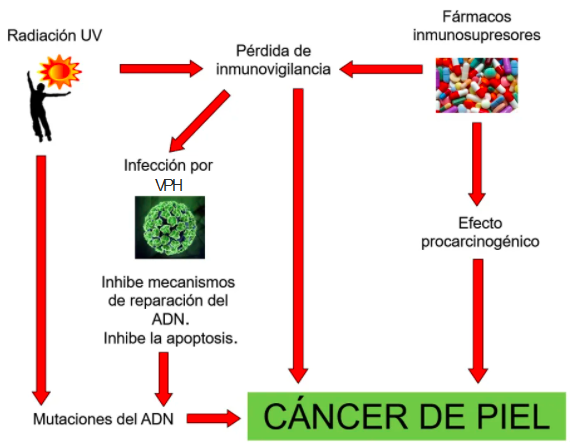
Gráfico 2. Principales mecanismos de la fisiopatogenia del CEC en pacientes trasplantados
En el sarcoma de Kaposi y el carcinoma de células de Merkel, los factores de riesgo predominantes parecen ser la intensidad total de la inmunosupresión, y la portación y reactivación del HHV-8 y del MCV (poliomavirus de células de Merkel), respectivamente. En el primero, la radiación ultravioleta no estaría implicada, mientras que en el segundo tendría un rol favorecedor.
Los fármacos inmunosupresores actúan de manera directa e indirecta sobre la oncogénesis. Generan pérdida de la inmunovigilancia y favorecen la proliferación de células neoplásicas y de virus oncogénicos. La azatioprina sensibiliza al ADN de los queratinocitos a la radiación UV mediante estrés oxidativo y favorece el desarrollo de mutaciones. El mofetil micofenolato, a pesar de ser también un antimetabolito, no presenta las propiedades mutagénicas de la azatioprina, por lo que tiene un riesgo relativo menor de generar cáncer de piel. La ciclosporina induce la producción de factores de crecimiento, tales como TGF-β y VEGF, que promueven la invasión tumoral y el desarrollo de metástasis; suprime la apoptosis inducida por el estrés oxidativo que genera la radiación UV sobre los queratinocitos, e inhibe al p53 con pérdida de control del ciclo celular. El riesgo de presentar tumores de piel aumenta con la cronicidad del uso de estos medicamentos (en especial, la azatioprina y la ciclosporina, por su doble mecanismo de acción), con dosis altas y ante la combinación de ellos. Por el contrario, el uso de fármacos inhibidores del mTor (sirolimus y everolimus) reduce el riesgo de cáncer de piel con respecto a otros esquemas inmunosupresores. El voriconazol es un antimicótico triazólico de amplio espectro, indicado, de forma frecuente, en trasplantados pulmonares y de médula ósea para tratamiento y profilaxis de micosis invasivas severas (aspergilosis). El voriconazol constituye un factor de riesgo independiente para el desarrollo de CEC.
Manifestaciones clínicas
El aspecto clínico del cáncer de piel en los pacientes trasplantados es similar al de la población general. Se diferencia porque en los receptores de TOS suele presentarse a edades más tempranas. La edad de desarrollo del primer tumor se reduce hasta 30 años, con una latencia desde el trasplante de 5 a 7 años en receptores menores de 50 años y de un año en los mayores. Además, son más frecuentes los tumores múltiples.
Las queratosis actínicas (QA) suelen ser más extensas y numerosas, y presentan mayor progresión a CEC, dado que hasta un 20 a 30 % de ellas evidencian esta evolución en un período de 5 a 10 años.
Tanto las verrugas virales como las lesiones de poroqueratosis que se asocian a la inmunosupresión por trasplante se consideran lesiones premalignas, al igual que las QA.
El CEC puede manifestarse de forma similar a la población general, aunque también es frecuente su presentación en forma de tumoraciones verrugosas difíciles de distinguir de las queratosis seborreicas, las verrugas virales, las QA hipertróficas y los queratoacantomas. El CEC suele tener un curso más agresivo, con mayor invasión subclínica, profundidad de infiltración, invasión perineural e intravascular.
El CBC se presenta habitualmente con variantes clínicas de tipo superficial y esclerodermiforme. Su crecimiento suele ser lento, y evidencia un comportamiento localmente agresivo e invasión subclínica de mayor extensión con respecto a la población general.
En los pacientes con TOS, existe un aumento de nevos atípicos y de melanomas que se originan en nevos preexistentes (38 %), en comparación con la población general (25 %). La frecuencia de presentación de los distintos subtipos de melanoma es similar a la de la población general. La localización más frecuente, tanto en hombres como mujeres, es el tronco.
El sarcoma de Kaposi (foto 2) es una neoplasia vascular multicéntrica que, en una de sus variantes, afecta a pacientes inmunosuprimidos (TOS y VIH/sida). Se presenta con máculas violáceas que evolucionan a placas violáceas hiperqueratósicas y tumores exofíticos que pueden ulcerarse y sangrar. Suelen localizarse en los pies y las piernas, con progresión de las lesiones en sentido proximal. Estas pueden asociarse a adenopatías locorregionales y, en menor medida, afectar a las mucosas, el sistema gastrointestinal, los pulmones y el hígado.
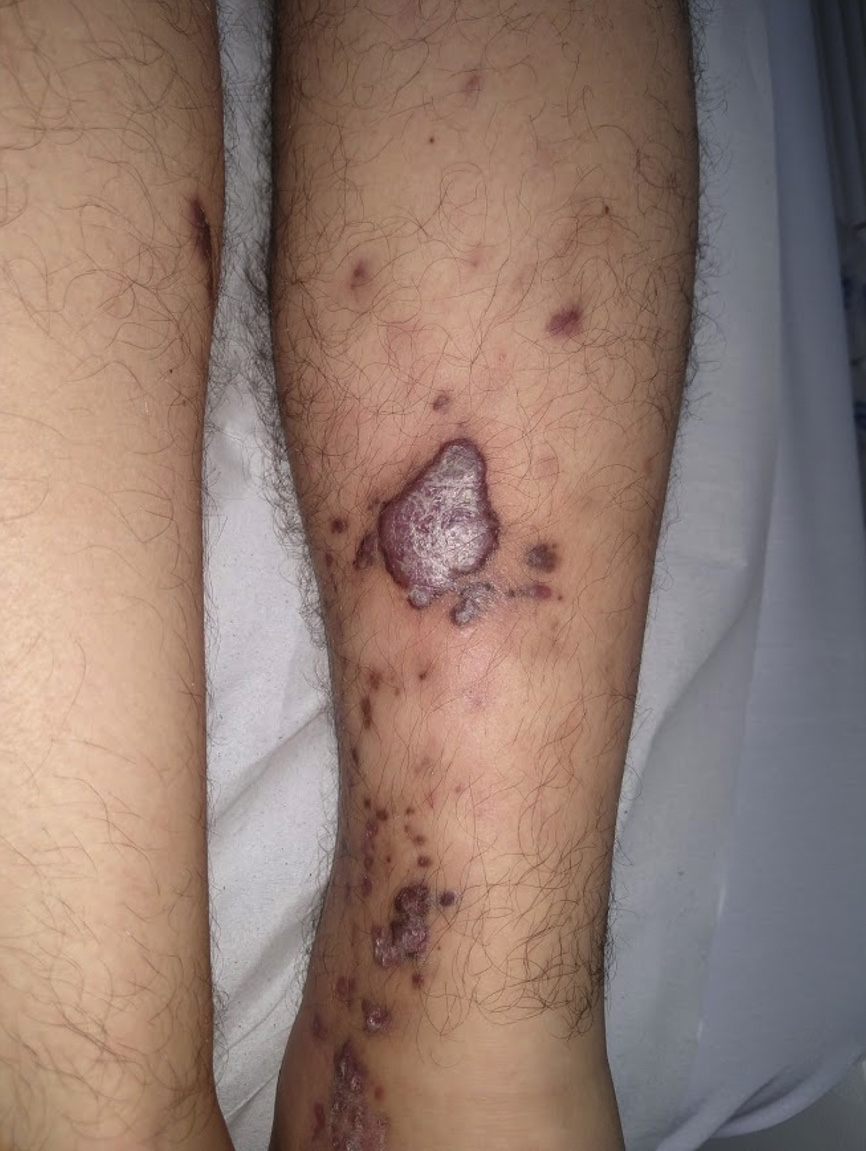 Foto 2. Sarcoma de Kaposi con compromiso de miembros inferiores en un paciente trasplantado renal
Foto 2. Sarcoma de Kaposi con compromiso de miembros inferiores en un paciente trasplantado renal
El carcinoma de células de Merkel se manifiesta como un tumor único, pardo violáceo, de consistencia firme y superficie lisa, que puede ulcerarse y suele localizarse en áreas fotoexpuestas. De rápido crecimiento, es localmente agresivo y presenta un riesgo elevado de diseminación ganglionar y a distancia.
Diagnósticos diferenciales
El mayor desafío radica en la detección precoz de lesiones neoplásicas invasoras en el contexto de un campo de cancerización (foto 3). En caso de lesiones verrugosas de etiología dudosa, se debe realizar biopsia para estudio histopatológico. En caso de tumoraciones ulceradas y sangrantes donde los patrones dermatoscópicos pueden no estar presentes, se debe tener en cuenta el diagnóstico diferencial con infecciones cutáneas profundas, oportunistas o ambas.
En el carcinoma de Merkel, el diagnóstico diferencial puede ser difícil. A nivel histológico, puede confundirse con metástasis de carcinoma de células pequeñas de pulmón, linfomas, melanoma y otros tumores fusocelulares.

Foto 3. Terreno de cancerización con presencia de lesiones verrugosas en un paciente trasplantado renal
Diagnóstico
Las QA y las verrugas virales suelen diagnosticarse por su aspecto clínico. Ante la sospecha de transformación a CEC, se debe realizar una biopsia por punch que incluya todas las capas de la piel para estudio histológico. Además del diagnóstico histológico, se debe evaluar el grado de diferenciación, el subtipo, la profundidad del tumor (índice de Breslow y Clark), la presencia de invasión perineural y vasculolinfática, y de inflamación. Para completar la estadificación y definir el tratamiento, se debe considerar el tamaño tumoral, la localización (alto, medio o bajo riesgo), la presencia de lesiones satélites y adenopatías locorregionales. En las lesiones de alto riesgo de compromiso ganglionar sin adenopatías palpables, puede ser útil solicitar una ecografía u otras imágenes. La indicación del estudio del ganglio centinela en CEC es controvertida. La clasificación del TNM para CEC en TOS no difiere de la estadificación en la población general. Sin embargo, la inmunosupresión es considerada un factor independiente de alto riesgo.
En el caso de sospecha de CBC, al no ser necesario conocer la profundidad de la lesión para su estadificación, la biopsia por afeitado es una opción válida. Se aconseja, a pesar de una alta sospecha clínica, el diagnóstico histopatológico para conocer el subtipo y grado histológico (es frecuente la coexistencia de más de un subtipo en la misma lesión), la invasión vasculolinfática y perineural. De acuerdo con las características clínicas e histológicas, se divide a los CBC en lesiones de alto o bajo riesgo, al igual que en la población general. La guía de la National Comprehensive Cancer Network (NCCN) considera a la inmunosupresión como un factor de riesgo independiente. Según esta guía, todo CBC en un paciente trasplantado es de alto riesgo.
Al igual que en la población general, ante la sospecha de melanoma, se debe realizar la escisión de la lesión en su totalidad, con un margen mínimo, para evaluar tamaño tumoral, tipo histológico, máxima invasión tumoral mediante el índice de Breslow, nivel de Clark, índice mitótico, fase de crecimiento, presencia de ulceración, regresión, infiltrado linfoide, invasión vasculolinfática y perineural, microsatelitosis, compromiso de márgenes periféricos y en profundidad. Sobre la base de la estadificación histopatológica, se definirá la necesidad de realizar el estudio del ganglio centinela e imágenes de extensión para completar la estadificación y definir el tratamiento.
En el sarcoma de Kaposi, la confirmación diagnóstica se realiza mediante el estudio histopatológico con tinciones de rutina, asociado a la búsqueda del HHV-8 mediante inmunohistoquímica. Se debe completar la evaluación por medio de estudios de extensión que permitan evaluar el compromiso sistémico (videoendoscopía alta y baja, y tomografía de tórax).
En el diagnóstico de carcinoma de células de Merkel, el estudio histológico que evidencia células con núcleo vesiculoso, pequeño nucléolo, abundantes mitosis y apoptosis, así como el perfil inmunohistoquímico (CK20 paranuclear positivo, CK7 negativo, sinaptofisina positivo, cromogranina positivo), son fundamentales.
Tratamiento
El tratamiento del cáncer de piel en los pacientes trasplantados debe basarse en la prevención, el diagnóstico precoz y la intervención terapéutica efectiva.
Se debe educar a los pacientes en fotoprotección desde el período previo al trasplante y reforzar estos conceptos en cada contacto.
Se tiene que fomentar el autoexamen cutáneo mensual para la detección de lesiones nuevas o cambiantes, en cuyo caso el paciente debe buscar la evaluación del especialista a la brevedad. La frecuencia de los controles dermatológicos depende de los antecedentes de cada paciente (ver «Seguimiento»).
Las QA, las verrugas virales y las lesiones de poroqueratosis deben tratarse de forma precoz. Las opciones terapéuticas son similares a las indicadas en la población general. De ser posible, se recomienda indicar tratamientos de campo de cancerización. De ellos, el 5-fluorouracilo (5-FU) permite una curación completa en el 75 % de los casos y el imiquimod en el 62 %. El uso de imiquimod en pacientes trasplantados fue cuestionado por el eventual riesgo de favorecer el rechazo del injerto debido a su efecto inmunomodulador. Ulrich y colaboradores demostraron, mediante un estudio prospectivo, multicéntrico, randomizado y doble ciego, que la aplicación de imiquimod al 5 % en crema, en un área de 100 cm², 3 veces por semana, durante 16 semanas es segura y eficaz en TOS. Perrett y colaboradores sugieren que la terapia fotodinámica (2 sesiones separadas por una semana) es efectiva en QA. Se destaca que en los pacientes con TOS estas lesiones suelen ser de difícil manejo y recidivantes, por lo que habitualmente es necesario combinar tratamientos.
El CEC en pacientes trasplantados debe tratarse mediante cirugía micrográfica de Mohs (CxMM) en caso de ser posible. La segunda línea de tratamiento es la escisión amplia con 10 mm de margen. Se desaconseja emplear métodos destructivos sin control histológico. En el caso de lesiones in situ menores de 10 mm o CEC tipo queratoacantoma menor de 5 mm en áreas de bajo riesgo, la escisión amplia con margen de 6 a 10 mm es la opción de elección. En pacientes seleccionados, con múltiples lesiones queratósicas diseminadas, la biopsia por afeitado con angulación del bisturí a 45 grados, con electrocuretaje posterior, es una opción descripta y válida, siempre que se ajuste el tratamiento al resultado histopatológico y sea posible un control clínico estricto.
La NCCN considera que todos los CBC en pacientes inmunosuprimidos deberían considerarse de alto riesgo y, por lo tanto, la primera línea de tratamiento es la CxMM.
El tratamiento del melanoma en TOS, hasta la fecha, no difiere del de la población general. La evidencia del uso de terapias sistémicas en casos avanzados es limitada. Se han empleado inhibidores de la vía BRAF/MEK e inmunoterapia (inhibidores del PD-1, como el nivolumab, y del CTLA-4, como el ipilimumab). Con este último tratamiento, se han comunicado casos de rechazo de injertos renales. El interferón no constituye una opción debido al riesgo de rechazo.
Con respecto al carcinoma de células de Merkel, no hay guías específicas de su manejo en TOS. La escisión quirúrgica con control de márgenes del tumor, si es posible mediante CxMM, es la indicación de elección. En caso de que fuera necesario, se puede complementar con radioterapia, al igual que en la población general.
En aquellos pacientes que hayan presentado múltiples tumores de piel o un tumor metastásico, CEC de alto riesgo o melanoma, se debe considerar reducir la inmunosupresión. En tumores localmente avanzados o metastásicos con mal pronóstico a corto plazo, es aconsejable evaluar la interrupción de la medicación inmunosupresora. En la medida de lo posible, se debe suspender o reemplazar la ciclosporina y la azatioprina en los casos que corresponda. Los inhibidores del mTor, sirolimus y everolimus, son fármacos inmunosupresores con propiedades antineoplásicas, por lo que su incorporación precoz puede resultar beneficiosa.
En el sarcoma de Kaposi, la primera línea de tratamiento es el descenso de la dosis de los inmunosupresores y su reemplazo por inhibidores del mTor.
En pacientes con más de 5 CEC en un año, queratoacantomas eruptivos y múltiples lesiones queratósicas en forma de campo de cancerización, se puede considerar la quimioprofilaxis con retinoides sistémicos (acitretina), nicotinamida o capecitabina. La evidencia que avala la eficacia de estos tratamientos es limitada. Los retinoides sistémicos disminuyen la proliferación epidérmica y la queratinización, inducen la apoptosis y son inmunomoduladores (tendrían mayor efecto en los queratinocitos infectados por VPH). Su uso en dosis bajas (acitretina 10-30 mg/d) disminuye las lesiones queratósicas y la aparición de tumores nuevos. Este tratamiento debe continuar de por vida para evitar el efecto rebote descripto ante su suspensión. Por este motivo, la selección de los pacientes candidatos a recibirlo es fundamental.
Es importante destacar que si bien la decisión del tratamiento en tumores de alto riesgo y la implementación de las terapéuticas sistémicas mencionadas pueden ser propuestas por el dermatólogo, deben ser determinadas por un comité interdisciplinario que incluya aquellas especialidades que cumplen un rol dentro del equipo de trasplante.
Evolución y pronóstico
Las lesiones premalignas y el cáncer de piel ocasionan un aumento de la morbilidad, disminución de la calidad de vida y repercusión psicosocial debido a la multiplicidad de tratamientos que los pacientes deben recibir y a los resultados quirúrgicos que, en muchos casos, mutilan o estigmatizan.
Se estima que la mortalidad atribuida al cáncer de piel en pacientes trasplantados es de 35,27 cada 100.000 personas por año (en la población general, es de 0,69 cada 100.000 personas por año) y supera a la mortalidad atribuible al cáncer de mama (11,52) y colon (23,53) en pacientes con TOS.
En cuanto al CEC, se estima que la recidiva es del 13 % (mayor en los primeros 5 años) y el 8 % de los pacientes desarrolla metástasis (mayor en los primeros 2 años). Dentro de estos últimos, el 56 % tiene recaída tumoral y el 50 % fallece.
En el CBC, el desarrollo de metástasis es excepcional.
El carcinoma de células de Merkel, al igual que el melanoma, tiene una mortalidad elevada con una supervivencia a los 5 años de entre el 30 y 64 %.
Seguimiento
Todos los pacientes con TOS deben ser controlados de forma periódica por un dermatólogo. El intervalo de tiempo entre controles dependerá de los antecedentes de cada paciente (tabla 3). En cada consulta, se debe realizar una evaluación de la piel y las mucosas, y reforzar las medidas de fotoprotección y las pautas de alarma para la realización del autoexamen mensual.
Tabla 3. Recomendaciones de seguimiento clínico en pacientes con TOS
| Antecedentes | Frecuencia de examen dermatológico |
| Sin antecedentes | Anual |
| Lesiones premalignas: QA, verrugas virales o poroqueratosis | Cada 6 meses |
| 1 CBC o CEC | Cada 6 meses |
| Múltiples cánceres de piel no melanoma | Cada 3-6 meses |
| Melanoma o CEC metastásico | Cada 3 meses |
Enfermedad de injerto contra huésped en trasplante de órgano sólido
La enfermedad de injerto contra huésped (EICH) ocurre cuando linfocitos T inmunocompetentes son transmitidos a un receptor inmunocomprometido portador de antígenos ausentes en el donante. En el trasplante de órganos sólidos, esta patología puede ser de dos tipos. La primera es una reacción humoral que se presenta con autoanticuerpos dirigidos contra los hematíes y se manifiesta con anemia hemolítica leve. La segunda es una reacción que se desarrolla por medio de la inmunidad celular y se presenta con compromiso sistémico multiorgánico que involucra la piel y las mucosas.
Epidemiología
Se estima que del 0,1 al 2 % de los pacientes con TOS padecen EICH. Se cree que la prevalencia aumenta al 5 % en pacientes que reciben trasplante de intestino delgado. Esto se debe a la carga de linfocitos transferida.
Es importante destacar que, a pesar de que la prevalencia de EICH en trasplante de intestino delgado es 5 veces mayor que en trasplante hepático, la mayor cantidad de pacientes con EICH en TOS son trasplantados hepáticos (64 %) debido a que este es el trasplante realizado con mayor frecuencia.
Fisiopatogenia
La patogenia de la EICH en TOS es compleja. Se sabe que la carga linfocitaria transferida en el órgano trasplantado, así como la relación entre la inmunogenicidad y la inmunosupresión del receptor, son los factores más relevantes para su desarrollo. También constituyen factores de riesgo para EICH en TOS el mayor grado de compatibilidad HLA, episodios de rechazo agudo con requerimiento de aumento de la inmunosupresión, la edad del receptor (los mayores de 65 años tienen 9 veces más riesgo), una diferencia de más de 40 años entre la edad del donante y la del receptor.
Los eventos que desencadenan la enfermedad se pueden agrupar en tres fases o etapas:
- Fase 1: los tratamientos a los que el receptor es sometido antes y durante el trasplante ocasionan toxicidad para los diferentes tejidos, en particular la piel y el tejido gastrointestinal. Citoquinas proinflamatorias, como el factor de necrosis tumoral (TNF, por su sigla en inglés) α y la interleucina (IL) 1, son liberadas por macrófagos y células epiteliales en respuesta a esta agresión. En consecuencia, aumenta la expresión de moléculas de adhesión, HLA y moléculas coestimuladoras. Esto lleva a la activación de las células presentadoras de antígenos (CPA) del receptor.
- Fase 2: los linfocitos T del donante son activados por las CPA del receptor, proliferan, se diferencian y se diseminan. Liberan IL‑2 e interferón gamma (IFN-ɣ), que, a su vez, estimulan la expresión de HLA-II. La IL‑2, bajo la influencia de citocinas reguladoras, tales como IL‑12, IFN-γ e IL‑18, amplifica la respuesta inmunitaria e induce la expansión clonal y la diferenciación de las células autorreactivas CD4+ y CD8+ en células efectoras de tipo Th1 citotóxicas.
- Fase 3: las células T activadas producen IL‑2, IL‑3, IL‑4, IFN-γ y TNF-α, que activan linfocitos, macrófagos y células natural killer (NK), las cuales finalmente conducen a la apoptosis de células blanco del receptor.
Manifestaciones clínicas
El inicio de las manifestaciones es muy variable, ya que se puede producir entre los 3 y los 240 días, con un promedio de 48 días, luego del trasplante.
La EICH suele presentarse con manifestaciones cutáneas y gastrointestinales, y progresa de forma rápida a enfermedad sistémica.
En el 88 % de los pacientes, se observan manifestaciones cutáneas y en el 75 % estas constituyen la primera manifestación. El cuadro suele presentarse con un exantema maculopapuloso eritematoso y/o purpúrico, que suele comprometer inicialmente palmas y plantas, y luego progresa al resto del tegumento. El exantema es coalescente y, en casos graves, puede evolucionar con la formación de ampollas. El 15 % de los casos presentan solo manifestaciones cutáneas sin compromiso sistémico.
El compromiso gastrointestinal se caracteriza por dolor abdominal, anorexia, dispepsia, diarrea y hemorragia digestiva. En casos de pacientes con TOS no hepático, puede observarse hepatitis y ascitis.
La infiltración por los linfocitos del donante de la médula ósea genera pancitopenia progresiva con neutropenia severa. Esto es signo de mal pronóstico, ya que aumenta el riesgo de hemorragias y sepsis.
En un paciente con TOS, la presencia de fiebre, erupción cutánea, pancitopenia, náuseas, vómitos y diarrea debe orientar el diagnóstico. La evolución del cuadro puede ser persistente o en brotes y remisiones hasta el desarrollo de una complicación grave, como sepsis. Esta última es la principal causa de muerte en estos pacientes. La mortalidad es alta y puede alcanzar entre el 72 y 75 %.
Diagnóstico
El diagnóstico de EICH en TOS se fundamenta en el cuadro clínico, el estudio histológico de los tejidos afectados y la detección de quimerismo molecular.
Histopatología cutánea
Los hallazgos que la caracterizan se agrupan en cuatro grados según la misma clasificación que los de la EICH asociada a trasplante de células hematopoyéticas:
- Grado I: vacuolización del estrato basal.
- Grado II: vacuolización del estrato basal + disqueratosis
- Grado III: necrosis de queratinocitos con áreas de despegamiento
- Grado IV: necrosis de toda la epidermis con despegamiento completo de la dermis
Histopatología gastrointestinal
La histopatología intestinal tendría mayor especificidad que la cutánea. Los hallazgos más característicos son el edema difuso de la mucosa y la presencia de un infiltrado linfoplasmocitario. La especificidad del estudio aumenta ante la presencia de apoptosis epitelial y destrucción glandular con gran desproporción entre los detritus celulares en la luz glandular y el escaso infiltrado inflamatorio en la lámina propia. Al igual que en el estudio histopatológico cutáneo, la afección intestinal se divide en distintos grados:
- Grado I: aumento de apoptosis en criptas
- Grado II: abscesos crípticos
- Grado III: necrosis de criptas
- Grado IV: mucosa denudada
Detección de quimerismo
Los pacientes trasplantados de órgano sólido pueden presentar linfocitos del donante circulantes (quimerismo) con intensidad decreciente a lo largo del tiempo. Valores muy elevados, levemente elevados pero persistentes, o su detección en tejidos periféricos se alejarían de la evolución normal y serían la causa de la EICH. Existen distintos métodos para detectar quimerismo:
- FISH con sonda para el centrómero del cromosoma Y
- Tipificación por detección serológica de antígenos de HLA A y B en sangre periférica
- Tipificación de antígenos HLA A, B y DR por PCR con primers de secuencia específica en sangre periférica
- Amplificación de repeticiones en tándem por PCR, con primers de secuencia específica en sangre periférica del donante, del receptor, y de biopsias del órgano afectado (alta especificidad y sensibilidad)
- FISH con sondas para detección de regiones polimórficas por repeticiones en tándem
Un valor mayor de 20 % de linfocitos del donante en sangre periférica del receptor luego de los 7 a 10 días del trasplante es altamente específico de EICH. Un valor menor puede indicar una EICH precoz o la evolución normal del quimerismo en el TOS. Niveles mayores de 1 % luego de 8 semanas del trasplante, junto con manifestaciones clínicas e histopatológicas compatibles, son sugestivos de EICH. En ausencia de clínica e histopatología características, la presencia de quimerismo no es específica e incluso puede ser normal en pacientes trasplantados. Por lo tanto, el diagnóstico no puede basarse exclusivamente en su detección.
Tratamiento
Debido a la baja incidencia de la EICH en TOS, los tratamientos que se implementan en la actualidad se fundamentan en reportes o series de casos. Se han descripto el tratamiento inmunosupresor con corticoterapia sistémica en dosis altas; la terapia antilinfocítica (la globulina antitimocito, la globulina antilinfocito y el anticuerpo monoclonal antilinfocito OKT3); el anticuerpo antirreceptor de IL 2 (CD25, basiliximab y daclizumab), infliximab y ruxolitinib, y la disminución o suspensión de la medicación inmunosupresora.
Por último, como ya se mencionó, se considera que la sepsis es una de las principales causas de muerte, por lo que el uso de profilaxis antibacteriana está establecido dentro de los protocolos habituales. Algunos autores sugieren ampliar el espectro antimicrobiano y cubrir al citomegalovirus y los hongos, patógenos aislados con frecuencia como causantes de infección y falla multiorgánica en estos pacientes.
Puntos clave
- El cáncer de piel es más frecuente en pacientes con TOS que en la población general, con predominio del CEC. Se presenta a edades más tempranas con mayor agresividad y ocasiona un aumento de la morbimortalidad.
- La etiopatogenia del cáncer de piel en los pacientes con TOS es compleja; los factores de riesgo asociados son la pérdida de la inmunovigilancia y el efecto carcinogénico de algunas drogas inmunosupresoras y ciertos virus oncogénicos.
- El tratamiento intensivo de las lesiones premalignas (queratosis actínicas, poroqueratosis y verrugas virales) evita la progresión a tumores invasivos.
- Ante lesiones sospechosas, se debe realizar, de forma precoz, una biopsia para estudio histopatológico.
- El tratamiento apropiado debe elegirse sobre la base de una correcta estadificación. Se desaconsejan los métodos que no permitan un control de márgenes.
- Además del tratamiento quirúrgico, se debe considerar, de manera interdisciplinaria, la necesidad de modificación de la inmunosupresión y/o la instauración de quimioprofilaxis sistémica.
- Como principal medida preventiva, es fundamental educar al paciente para que adopte medidas de fotoprotección y se realice un autoexamen mensual, con pautas de alarma, para que consulte de forma precoz si fuera necesario.
- La frecuencia de los controles dermatológicos periódicos dependerá de los antecedentes y el riesgo de cada paciente.


